 지상강좌
지상강좌 - A Study of Adverse Drug Event Reporting Systems in Korea
Nakyung Yoon, and Minku Kang*
College of Pharmacy, Woosuk University, Jeonbuk 55338, Republic of Korea
- 한국 의약품 부작용 보고제도에 관한 고찰
윤나경, 강민구*
우석대학교 약학대학
Pharmacovigilance is an essential component of healthcare systems that helps to ensure the safety of drugs, as data is systematically collected. It can help to determine the frequency of a particular side effect that occurs in clinical practice, which data can further contribute to creating more evidence-based guidelines. Spontaneous adverse drug reaction (ADR) reporting program, a type of pharmacovigilance activity, collects post-marketing data; this data can be used to prevent the occurrence of future ADRs. The purpose of this paper is to review the current status of the Korean ADR surveillance system and suggest possible solutions for developing a more active pharmacovigilance system in Korea.
Keywords: pharmacovigilance, adverse drug reaction, side effect, healthcare systems, ADRs
의학의 발달과 함께 질병치료에 대한 기대감이 높아지고 약물안전성에 대한 관심은 크게 증가하고 있는 상황에서 약물안전성 관련 자료와 허가사항은 현재까지 대부분 서양인을 기준으로 한 연구결과들로 구성되어 있기에 한국인을 대상으로 약물안전성 자료를 생산하고, 이를 바탕으로 허가사항 변경 등 국가기관에서의 정책 반영과 제약사 등 민간부분에서의 위해관리계획 수립 및 임상현장에 적절한 정보를 제공해야 한다는 의약품 안전관리의 중요성에 대해 사회적으로 강조되고 있다.1,2)
약물안전성 관련 자료 중 하나인 시판 전 임상시험은 한정된 수의 피험자 중 엄격한 선정기준의 실험자를 대상으로 연령, 기저질환, 병용 약 등이 매우 비현실적으로 단순화되어 있고, 투여기간과 관찰기간이 짧다. 또한, 시험평가지표에 관련한 항목에만 집중해 있어 불특정 다수가 시판 후 다양한 환경에서 사용할 때에 대한 현실적인 안전성 정보를 얻기 어렵다. 따라서 시판 후 약물감시는 실제상황에서 예상하지 못한 유해사례, 약물상호작용, 의존도, 장기간의 효과, 약물내성 등 다양한 약물의 현실적인 안전성관리를 할 수 있다는 점에서 중요성이 강조되고 의료인에 의한 자발적 약물부작용 보고는 시판 후 약물감시체계의 핵심이 되고 있다.2,3)
흔히 발생하는 부작용은 시판 전 임상시험에서 걸러질 수 있으나 드물게 발생하는 부작용의 경우에는 시판 후 많은 환자가 사용하고 나서야 확인할 수 있다.3 최근 10년간 국내?외에서 의약품이 시판된 이후에 안전성 또는 유효성 문제 때문에 국내 허가취소 되거나 판매 중지된 사례는 다음과 같다(Table 1).4)
따라서 지역약물감시 프로그램은 단지 예측하지 못한 약물부작용을 찾기 위한 활동이 아닌 안전한 약을 만들기 위한 필수적인 사업이고, 실제 임상에서 발생하는 각각의 약물부작용 빈도를 측정할 수 있어서 신뢰할 수 있는 복약지도문을 만드는데 크게 기여할 수 있으며, 일반 시민의 잘못된 약물부작용 개념을 바로잡을 수 있는 기회가 된다. 또한 환자와 의료인 간의 신뢰를 쌓을 수 있는 기회가 되어 우리 사회의 의료소비수준을 한 단계 올릴 수 있을 것으로 생각된다.3)
현재 외래처방 및 일반의약품 등의 모니터링 강화를 위해 2013년 지역의약품안전센터가 지정되었고 그 후 외래처방 및 일반의약품 등에 대한 이상사례보고가 많이 증가됨으로써 우리나라 약물감시활동이 보다 더 면밀해지는 결과를 낳았다. 대한약사회 지역의약품안전센터가 지정된 지 6년이 지난 지금, 본고에서는 약물감시 의의를 살펴보고 대한약사회 지역의약품안전센터에서 실시 중인 약물감시현황 및 부작용 보고방법에 대해 살펴보고자 한다.5)
|
Table 1 The cancelled and/or suspended pharmaceuticals associated with safety or effectiveness problems since 2000 in Korea |
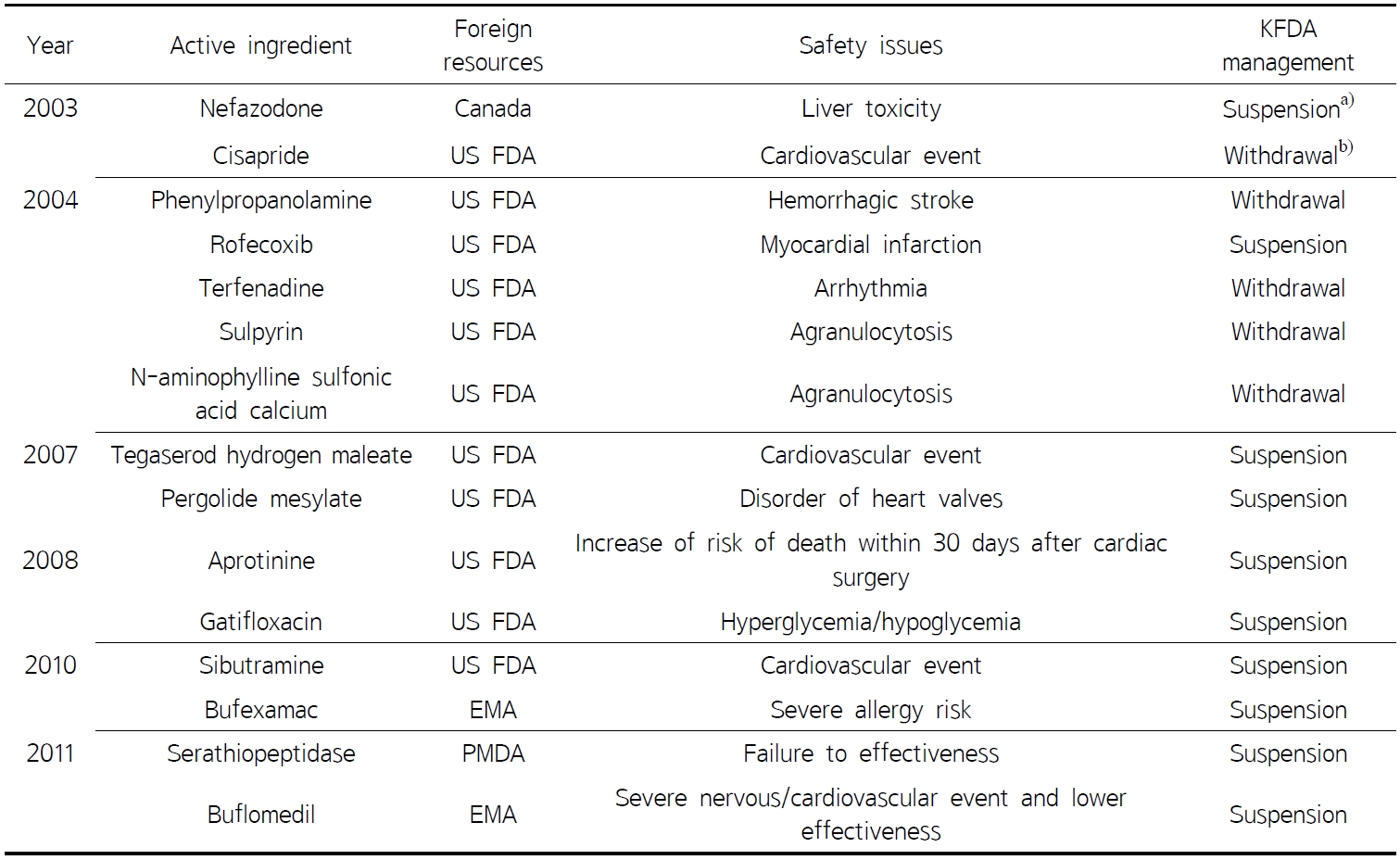
FDA (Korea Food and Drug Administration); US FDA (US Food and Drug Administration); EMA (European Medicines Agency); PMDA (Pharmaceuticals and Medical Devices Agency) |
1. 부작용 보고의 역사
세계보건회의(The World Health Assembly)는 1962년에 일어난 탈리도마이드(talidomide) 사건 이후 세계보건기구 사무총장에게 약품의 중증부작용에 대한 새로운 정보를 각국의 보건당국에게 신속히 전달하게 하는 등 전 세계적으로 유통되고 있는 의약품에 대한 안전성을 확보할 것을 목적으로 하는 여러 조치들에 대한 실행가능성을 검토해 볼 것을 요청했고 이와 같은 문제에 대한 검토는 세계보건회의가 적극적으로 앞장섬에 따라 계속되어 왔으며, 그 기간 동안 각 회원국가들은 의약품 개발과정 중, 특히 허가 후 나타나는 중증부작용 정보에 대한 체계적인 수집방안을 강구하도록 요청받았고 그로 인해 현재 웁살라모니터링센터(the Uppsala Monitoring Centre, 이하 UMC)가 생겨났다.
UMC의 역사를 거슬러 올라가보면 스웨덴 웁살라(Uppsala)에 위치한 UMC는 세계보건기구(이하 WHO)의 국제약물감시센터(International Health Monitoring Collaborating Center for International Drug Monitoring)의 필드이름이고 시범적 사업은 1968년에 미국정부가 제공한 버지니아주 알렉산드리아 소재의 한 건물에서 세계보건기구 직원에 의하여 시작되었다. 그 후 세계보건회의는 1971년 1월 제네바에 있는 세계보건기구 본부로 옮긴 후 다시 1977년 제 30차 세계보건회의에서 스웨덴 웁살라에 소재한 세계보건기구 협력센터로 이관할 것을 결정함에 따라 1978년에 이관되어 현재에 이르고 있다.6) 1978년부터 UMC는 WHO의 국제약물감시프로그램 관리책임을 수행하고 의약품의 효능, 피해, 효과 및 위험과 관련하여 회원국의 국가 약물감시센터로부터 정보를 수집, 평가 및 전달함으로써 활동하고 있다.4,7) 우리나라에서는 1988년부터 자발적부작용보고제도를 시행하고 있으며 1992년에 세계보건기구(World Health Organization, WHO) 국제약물모니터링센터에 가입하였다.1)
2. 약물감시(Pharmacovigilance)
약물감시(Pharmacovigilance)는 “약”이라는 뜻의 그리스어 Pharmakon과 “계속 깨어 있으면서 지켜보고 경계한다”는 뜻의 라틴어에서 유래한 합성어이다. 의약품은 질병을 관리하고 통제했으나 모든 이점에도 불구하고 약물유해반응(Adverse Drug Reaction, ADR) 즉, 정상적인 용법/용량으로 약물을 투여한 후 발생한 유해하고 의도하지 않은 반응으로써 해당 의약품과의 인과관계를 배제할 수 없는 경우가 발생하고 있다. 이는 환자의 입원과 치료기간 연장을 유발할 뿐만 아니라 치료비용을 상승시켜 환자와 보험재정의 경제적 부담을 가중시킨다.10)
미국의 경우, ADR로 인한 외래진료가 연간 약 4,335,990건이었고 ADR로 인해 입원 1건당 평균 4,685달러의 추가비용이 발생하는 것으로 보고된 바 있으나 국내의 경우 아직까지 약물유해사례 발생규모나 피해현황에 대해 체계적으로 연구한 결과가 없다.9) 심지어 일부 국가에서는 ADR이 사망 원인 상위 10위 안에 포함된다. ADR은 제품 자체와 관련된 본질적인 위험을 제외하고, 개별 환자는 특정 의약품에 대해 특별하고 예측할 수 없는 민감성을 나타낼 수 있다. 또한 한 가지 이상의 약이 처방되는 경우 부정적인 상호작용의 위험이 있다. 이러한 ADR은 질병, 장애 및 심지어 사망의 흔한 원인이지만 예방가능하나 계속 일어나고 있다. 그러므로 환자의 상해를 예방하거나 줄이고 공중보건을 향상시키기 위해서는 임상적으로 사용되는 의약품의 안전성을 평가하고 모니터링하는 메커니즘인 약물감시는 중요하고 개인을 위한 주어진 가능한 많은 선택에서 가장 안전한 약의 선택과 사용은 약물감시로부터 시작된다.
또한 실제로 이것은 잘 조직화 된 약물감시시스템을 갖추어야 한다는 것을 의미한다. ADR 모니터링 및 평가프로세스를 설명하는 데 사용되는 포괄적인 용어인 약물감시(pharmaco-vigilance)는 효과적인 약물규제시스템, 임상실습 및 공중보건 프로그램이 주요 구성요소이다.8,9) 식품의약품안전청(이하 식약청)은 지난 2004년 ‘의약품 등 안전성정보관리규정’을 개정하면서 의약품 안전성 평가와 관련된 용어를 다음과 같이 정의하였다.9)
2.1 약물감시 용어9)
| 부작용 (Side Effect) | 의약품 등을 정상적인 용량에 따라 투여할 경우 발생하는 모든 의도되지 않은 효과를 말하며 이상사례(Adverse Event/Adverse Experience, AE), 약물이상반응(Adverse Drug Reaction, ADR), 실마리정보(Signal) 등을 포함한다. |
| 이상사례 (Adverse Event/Adverse Experience, AE) | 의약품 등의 투여・사용 중 발생한 바람직하지 않고 의도되지 않은 징후(sign, 예를 들면 실험 실적 검사치의 이상), 증상(symptom) 또는 질병을 말하며, 당해 의약품 등과 반드시 인과관계를 가져야 하는 것은 아니다. |
| 약물이상 반응 (Adverse Drug Reaction, ADR) | 의약품 등을 정상적으로 투여・사용하여 발생한 유해하고 의도하지 아니한 반응으로서 해당 의약품 등과의 인과관계를 배제할 수 없는 경우를 말하며, 자발적으로 보고된 이상사례 중에서 의약품 등과의 인과관계가 알려지지 않은 경우에는 약물이상반응으로 간주한다. 다만, 보고자와 제조자/의뢰자 모두가 의약품 등과 관련이 없다고 판단한 경우에는 약물이상반응에서 제외하고 있다. |
| 실마리정보 (Signal) | 약물과 이상사례간 새로운 잠재적 인과관계 또는 알려진 관계의 새로운 측면을 제시하는 정보로서 하나 또는 그 이상의 보고원으로부터 얻어지는 정보 중에서 분석할 만한 가치가 있는 정보이며, 그 관계가 유해한 것에 국한되지 않는다. |
3. 약물감시가 중요한 이유
의약품의 임상개발과 관련된 프로세스는 Fig. 1에 설명되어 있다. 대부분의 의약품은 제한된 수의 통제된 사람들을 대상으로 단기간의 안전성과 효능을 테스트한다. 좁은 조건의 피검자와 제한된 환경의 임상시험에서 벗어난 시장에 출시되면 의약품은 안전하고 보호된 과학적 환경의 임상 시험을 떠나기 때문에 일반 소비자가 실제 생활조건에서 효과와 안전성을 모니터링하는 것이 필수적이다. 특정 인구집단, 특히 어린이, 임산부 및 노인, 만성사용의 효능 및 안전성, 특히 다른 의약품과의 조합에 대한 사용에 대해서는 더 많은 정보가 필요하다.
약물감시가 중요한 이유는 모든 의약품에 존재하는 이익과 해악의 잠재력 사이에 균형을 유지하고, 치료결정을 내릴 때 좋은 품질, 안전 및 효능의 의약품, 그리고 환자의 설명 및 우려 사항을 고려하여 피해를 최소화할 수 있게 도와주기 때문이다. 또한 보건서비스에 대한 자신감을 주는 의약품을 사용해 환자들에게 높은 신뢰감을 줄 수 있으며 약물사용의 위험을 예방하고 관리할 수 ??있도록 보장한다. 또한 의료인들에게 그들이 처방한 의약품의 효과와 위험을 이해하도록 교육할 수 있고 사용에 관한 권고안을 개정하기 위해 필요한 정보를 규제당국에 제공할 수 있다. 이로써 보건전문가와 대중간의 의사소통을 향상시킨다. 이것이 약물감시의 중요한 역할이다.8)
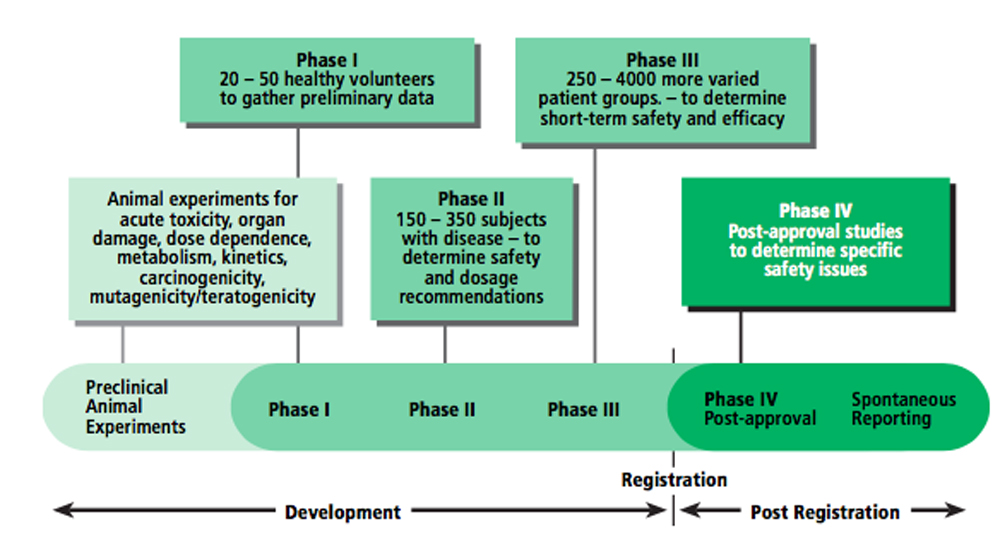
|
Fig. 1 Clinical development of medicine. |
4. 우리나라 부작용 신고제도
4.1 우리나라 부작용 보고현황
우리나라 부작용 신고제도는 1988년 의약품 부작용 모니터링제도를 도입한 이래 여러 차례 제도의 보완과 수정을 거쳐, 2006년부터는 식품의약품안전처에서 지역의약품안전센터(구 지역약물감시센터, regional pharmacovigilance center)를 지정하고 이를 통해 자발적인 ADR 보고를 받고 있다. 대한약사회 지역의약품안전센터는 식품의약품안전처 산하 한국의약품안전관리원에 의해 국립의료원 지역의약품안전센터와 함께 전국적 범위의 약물감시활동을 위해 2013년 2월 지역의약품안전센터로 지정되었다. 각 시도 거점지역을 대상으로 약물감시활동을 하는 기존의 지역의약품안전센터와는 달리, 국립의료원 지역의약품안전센터는 전국 보건소를 활동대상으로 하고, 대한약사회 지역의약품안전센터는 전국 약국과 외래환자를 대상으로 활동을 수행하도록 지정되었다.10)
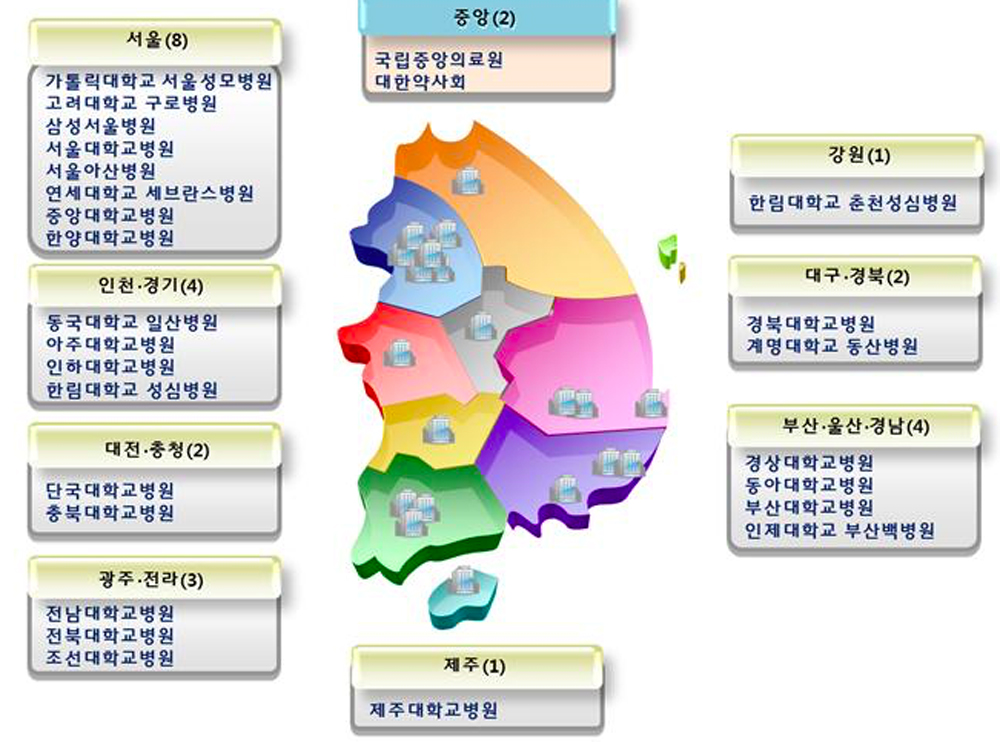
2006년 식약청에서는 3개 대학병원(세브란스병원, 아주대병원, 서울대병원)을 지역약물감시센터로 지정한 이후, 부작용 보고건수가 급격히 증가하기 시작하여 2011년 12월 31일 현재 누적건수가 165,430건으로 선진국 수준으로 진입하게 되었다. 2007년 6월 11일부터 2012년 6월 11일까지 WHO 국제 약물모니터링 센터에 인구 백만명 기준으로 보고한 순위로 우리나라는 14위에 올랐다. 현재 부작용보고는 27개 지역약물감시센터 위주로 이루어지고 있고 지역약물감시센터는 현재 대형병원 위주로 지정되어 있다(Fig. 2).
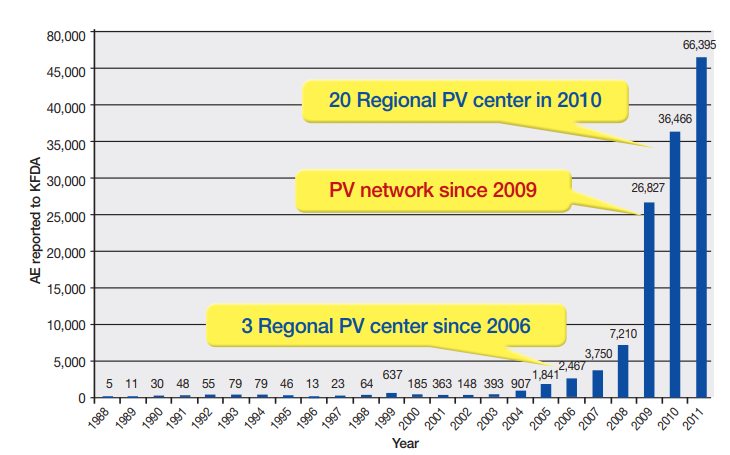
지난 10년간 우리나라의 의약품 유해사례 보고수집 현황은 Fig. 3과 같다.1)
2009년부터 국내 의약품 부작용 보고건수가 급속한 증가추세를 나타내는데 그 주된 이유는 이 시기에 식품의약품안전청에서 지역약물감시사업단을 조직하는 등 부작용 보고 활성화를 위한 다양한 정책을 추진되었고, 동시에 각 지역약물감시센터에서도 부작용보고의 필요성에 대한 공감대 형성을 기반으로 체계적이고 전문화된 시스템을 구축하여 추진한 결과에 기인한 것으로 추정된다. 2009년 이후 국내 유해사례 보고건수가 증가하였지만 지역약물감시센터에서 참여자의 진료분야를 중심으로 병원처방 전문의약품 위주의 유해사례가 주로 수집되고 약국과 소비자로부터 일반의약품 관련 유해사례 수집은 매우 낮은 수준에 머물고 있는데 그 이유는 의료진의 긴밀한 모니터링 하에 있는 입원환자에 비해 외래환자는 환자의 자발적인 의사표현이 없으면 ADR을 알아내기 어렵기 때문이다.3)
또한 국내 약국에서의 연도별 약물감시현황을 살펴보면, 약국의 약물감시활동이 전개되면서 약국에서 대한약사회 지역의약품안전센터로 부작용 보고를 참여한 약국의 수도 증가되었다. 연도별 이상사례 보고 참여 약국 수를 보면 2013년에는 527개의 약국이 참여하였으나, 2014년 764개, 2015년 735개의 약국이 참여하였다. 특히 적어도 한 건 이상의 이상사례 보고에 참여 한 약국의 수는 2016년 상반기까지 1,455개로 지속적으로 증가하고 있다. 이들 약국은 전국에 골고루 분포되어 있어 대한약사회가 지역의약품안전센터 활동에 참여함으로써 우리나라의 약물감시망을 더욱 더 촘촘하게 하는 것에 기여하고 있음을 알 수 있다.
따라서 지역의약품안전센터와 약국간 공조를 통해, 외래환자에 대해 적극적인 약물감시 활동을 수행하고, 수집된 외래환자의 ADR을 분석하여 예방활동에 이용하려는 노력이 필요하다.5) 왜냐하면 약국은 접근성에서 약에 관한 상담이 용이하며, 이를 통해 외래환자의 ADR을 효과적으로 모니터링하고 상담 및 정보를 제공할 수 있는 요양기관이기 때문이다.
| 구분 | 2013년 | 2014년 | 2015년 | 2016년 상반기 |
| 당해 참여약국 수 | 527 | 764 | 735 | 578 |
| 누적 참여약국 수(A) | 527 | 1,028 | 1,314 | 1,455 |
| 복지부 등록약국수(B) | 20,890 | 21,058 | 21,267 | 21,261 |
| 누적참여약국비율 (A/B*100) | 2.5% | 4.% | 6.2% | 6.8% |
하지만 “현재 약사들이 하는 복약지도 중 의약품 이상반응을 발견할 시 89.5%가 의약품부작용 보고를 한 경험이 없다는 연구결과가 있었다.”11) 이는 의약품부작용 보고가 활성화되어 있지 않음을 의미하고 그 이유로는 약사들이 부작용보고를 하기에는 보고서 양식이 복잡하며 약사회의 부작용보고 교육프로그램이 없는 것으로 나타났다. 약사들이 부작용 보고할 의지는 있지만 보고서 작성양식의 현실화와 지역약물감시센터의 역할이 중요한 것으로 밝혀졌다.10)
참고로 본 임상정보에서는 약국에서 처방프로그램 별 부작용 보고방법에 대해 대한약사회 지역 의약품 안전센터에서 정보를 받아 첨부했다(2019. 5 기준).
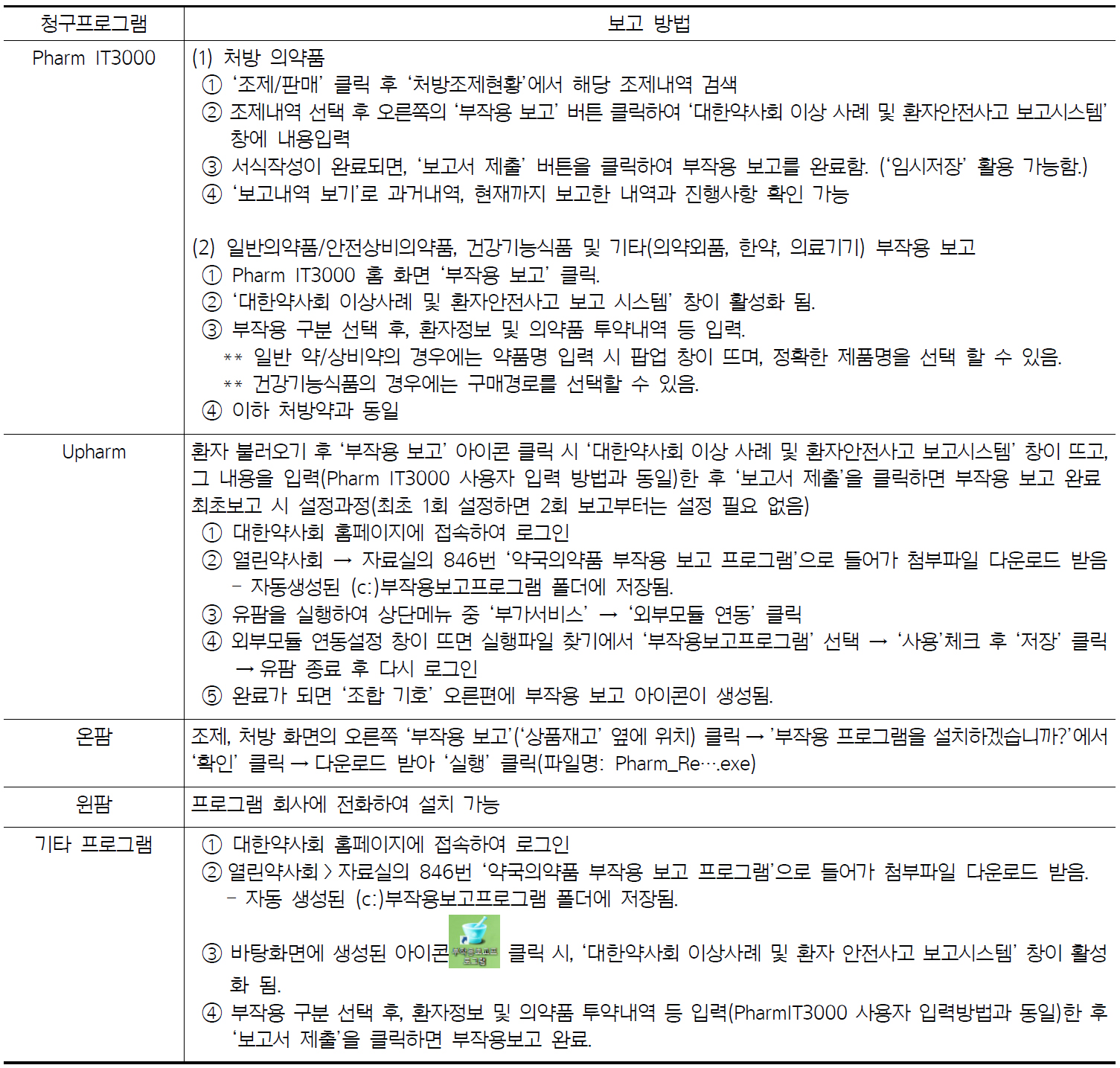
4.2 우리나라 약물감시체계 절차
현재 우리나라에서 의약품의 복용으로 인한 약물유해반응을 감시하는 체계는 1) 자발적 부작용 신고제도와 2)재심사제도, 3) 재평가제도 등이 있다. 감시체계 중 본고에서 다루는 1) 자발적 부작용신고제도는 시판 후 약물의 유해반응 정보를 조기에 수집하고 분석하여 실마리 정보를 탐색하고 안전성 정보생산에 중추적 역할을 하는 제도이다.1)
또 다른 감시체계인 2) 재심사제도는 신약의 안전성, 유효성에 관한 자료를 허가 후 4년 내지 6년간의 시판과정에서 수집하여 이미 허가된 사항을 재검토하여 의약품의 안전성, 유효성을 재확인하는 취지로 시행되고 있고 자발적 부작용신고제도가 현실적으로 신고건수가 미미하여 그 기능을 제대로 발휘하지 못하고 있는 상황이므로 재심사제도라는 안전장치를 마련하여 수행하는 것이다. 또한 3) 재평가제도는 신약이 시판허가 받은 후 일정기간마다 그 안전성 및 유효성을 재검토하여 허가사항에 반영할 필요성이 인정되어 1975년부터 의약품 재평가제도가 시행되고 있다.9)
자발적 부작용 보고를 받는 지역약물감시센터의 경우는 의사, 약사, 간호사 등 전문인력으로 구성된 조직이 구성되어 있으며, 원내 및 지역 부작용감시 활성화를 위해서 원내 의무전자기록(electronic medical record)을 이용한 약물유해반응시스템 구축, 원내 유해반응 모니터링 업무 및 상담실을 지속적으로 확충하고 있다, 또한 원내 약물유해반응 보고에 대한 교육 및 홍보활동 강화로 관련 전공자의 교육, 소식지를 발행하여 관할지역 의료인에게 배포하고 있다.
대한약사회 지역의약품안전센터에서는 지역약물감시센터와 한국의약품안전관리원에 접수된 이상사례들을 전문가들이 WHO-UMC 평가기준을 이용해 인과성 평가를 실시한다. WHO-UMC 평가기준은 Table 2에 제시했다.
대한약사회 지역의약품안전센터에서 전문가들이 진행하는 인과성 평가와 관련하여 몇 가지 사례는 다음과 같다.
1) A환자가 병용약물과는 이상사례 인과관계가 없고 의심약물 약리작용에 의함이 확실하고, 투여 중단 후 이상사례 회복이 나타나면서 재투여시 이상사례가 다시 발생할 경우 ‘확실함(certain)’으로 평가한다.
2) B환자가 병용약물과는 이상사례 인과관계의 가능성이 낮고 의심약물 약리작용에 의한 가능성은 있는데 투여중단 후 이상사례에서 회복되었고 재투여시 여부는 모를 경우 ‘가능성 높음(Probable)’으로 평가한다.
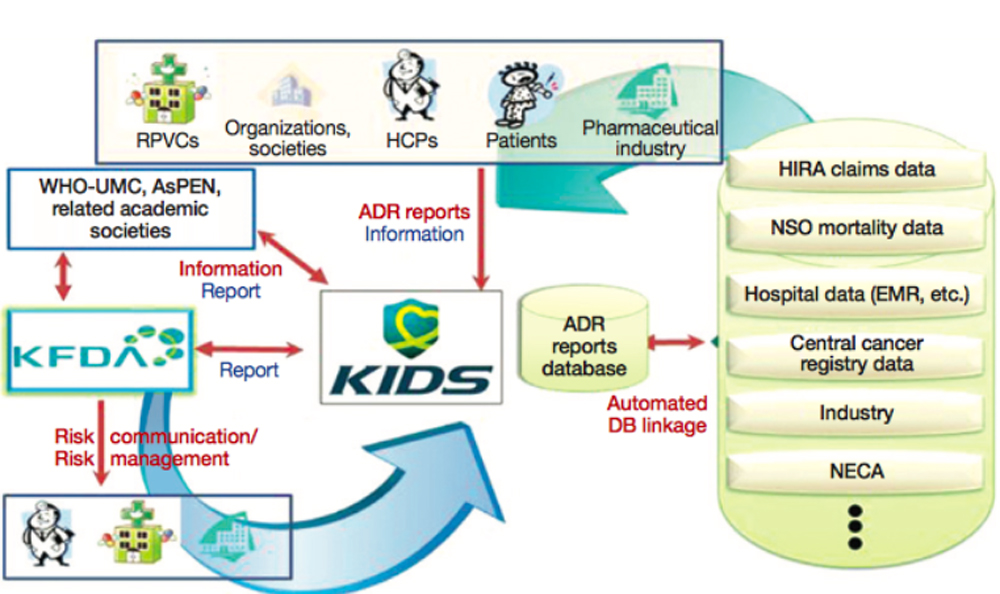
상기 예와 같이 인과성 평가한 내용들을 모아서 유해사례 보고DB를 구축한다. 한국의약품안전관리원에서는 이렇게 구축된 유해사례보고DB를 이용해 여러 단계를 거쳐 국내 안전성정보를 생산한다(Fig. 4).
먼저, 약물유해반응의 실마리 정보 탐색을 시작으로 국내 자발적 부작용 보고자료를 이용하여 약물유해반응 실마리정보를 검색하고 평가한다. 안전성정보를 생산하기 위해서는 대상 약물의 선정, 데이터베이스의 재구축, 데이터 마이닝 지표산출, 유해사례 보고건수 검토, 우선 순위화 알고리즘에 따른 평가, 우선 선별된 실마리 정보의 국내외 허가사항 검토, 의약품 데이터베이스 확인, Uppsala Monitoring Center (UMC) 보고 건 조사, 문헌 등 자료원 조사, 유의미한 안전성 정보 여부 검토, 안전성 정보 도출, 허가사항 반영 등의 절차를 따른다(Fig. 5).
|
Fig. 2 27 regional drug safety centers in 2014 (Source: Korea Institute of Drug Safety & Risk management) |
|
Fig. 3 Spontaneous adverse event reports in Korea. AE (adverse event); KDFA (Korea Food and Drug Administration); PV (pharmacovigilance). |
|
Fig. 4 National adverse drug reaction monitoring system. |

|
Fig. 5 5 Establishment and management procedure of medical safety information DB (Source: Korea Institute of Drug Safety & Risk Management). |
최근 우리나라에서도 시사프라이드(2000’) 페닐프로판올아민(2000’) 로페콕시브(2004’)와 같이 널리 시판되던 약물들이 안전성의 문제로 시장에서 퇴출되었지만, 모두 외국에서 먼저 실마리정보를 파악한 후 해당국가의 조치가 내려진 다음에 우리나라에서 시판 금지 결정이 내려졌다. 물론 페닐프로판올아민의 경우에는 우리나라에서 잘 계획된 다기관 환자-대조군 연구 설계를 이용한 약물역학연구를 수행하였지만 이 경우에도 외국에서 먼저 실마리정보가 파악되어 우리나라 사람들을 대상으로 약물과 인과관계가 있는지 검증하는 연구였다. 2000년에 미국이 세계에서 가장 먼저 페닐프로판올아민 사용을 중단해 자국민을 보호한 것처럼 우리나라도 시판 전 알려지지 않은 약물유해반응에 의하여 자국민을 보호할 수 있는 약물유해반응 감시체계가 그 역할을 충실히 수행하여야 할 것이다.9)
한국의약품안전관리원은 의약품의 안전성정보를 수집?분석?관리하는 데 있어서 의약품 유해 사례보고시스템을 선진국 수준으로 구축하는 것이 매우 중요하다고 생각해서 유해사례보고의 중요성 및 보고방법을 교육하고 홍보하는 활동이 확대되어야 하며, 자발적으로 신고되는 국내 약물부작용은 물론 외국의 안전성 정보를 체계적으로 검토하고 우리나라 사람들을 대상으로 평가하여야 한다. 또한 지역약물감시센터의 확대를 통하여 포괄적 약물감시체계를 구축하고 대형병원 또는 심평원 등의 전산화된 의료정보를 이용하여 능동적으로 실마리정보를 검색할 수 있는 시스템을 개발하여야 한다. 더불어 이러한 과정을 통하여 파악된 실마리정보는 한국의약품안전관리원에서 일차적인 인과성평가를 수행하여 그 결과를 신고자에게 환류해주고 또는 대중에게 공개하고 피드백을 줌으로써 보고의 지속적인 동기부여가 되어, 필요한 경우는 잘 계획된 약물역학연구를 수행하여 과학적인 근거를 확보한 후, 식약청에서 적절한 행정조치를 할 수 있도록 건의하여 대중과 소통하는 선 순환적인 약물감시체계로의 발전이 필요하다.2,9) 나아가 미국, 유럽 등에서 적극적으로 시도되고 있는 대규모 전산자료원을 활용한 약물감시 분야는 전국민의료보험체계와 IT인프라를 갖춘 우리나라가 선도할 수 있을 만큼 강점을 가지나, 개인정보보호법 강화로 어려움이 있는 실정이다. 하지만 윤리적인 연구수행과 철저한 개인정보 보호 보안시스템을 전제로, ‘개별적 정보’라는 ‘구슬’을 꿰어 공익적 목적의 ‘근거’라는 보배를 생성할 수 있도록 법적, 제도적 장치를 보강하여야 할 것이다.1)
또한 개인정보규정 준수범위 내에서 단계적으로 후향적 DUR을 도입하고 의약품부작용 보고기능을 탑재해서 부작용 보고 시 자동으로 DUR 알림창이 생성되어 그 환자의 특정약품에 대한 부작용 정보를 확인하거나 보고할 수 있는 제도가 필요하다. 이러한 제도가 있으면 의약품 부작용에 대한 좀 더 정확한 규명이 가능하며 더 나아가서 환자의 의약품 처방패턴의 문제점이나 특정 약물에 대한 부작용을 확인할 수 있으며 다른 의료기관과 약국을 방문할 때도 기존의 약물에 대한 부작용정보를 확인할 수 있게 된다. 이러한 기능이 활성화되고 안정화 되기 위해서는 개인정보보호에 관한 기능을 강화하며 DUR에 좀 더 많은 권한과 기능을 제도적으로 뒷받침해야 한다.10)
지금까지 우리는 약물의 효능을 더욱 중시하고 관심을 가져왔지만, 약물의 효능만큼 다른 면에는 건강을 해칠 수 있는 부작용이 존재한다는 사실을 인지하고 방지할 수 있는 시스템을 갖춰야 할 시점이 되었다. 약물의 부작용은 FDA 승인을 받은 약일지라도 발생할 가능성이 많으며, 약의 충분한 안전성을 입증하기 위해서는 시장에 출시된 후 10여 년 이상이 걸린다고 한다.12 자발적인 부작용 신고는 안전한 약을 만드는 데 기본이 되고, 약물유해반응 발생을 예방할 수 있기에 약물의 부작용을 모니터링하는 시스템을 체계화하는 것은 국민건강과 직결되는 국가적 과제이기도 하다. 자발적 부작용신고는 사회의 한 일원으로서 의료인의 당연한 의무이기에 적극적인 참여가 필요하다.3,12) 또한 약국은 약물의 조제 및 투약에 있어서 최전선에 있는 곳으로서 지역약국에서 근무하는 약사의 적극적이고 자발적인 부작용 모니터링은 국민보건증진과 환자보호를 위해 매우 중요하다고 할 것이다.
- 1. Chung SY, et al. The role of the KIDS for enhancing drug safety and risk management in Korea. J Korean Med Assoc 2012;55(9):861-8.
-
- 2. Shin SM, Chung SY, et al. An Overview of MedWatch System. Korea Institute of Drug Safety and Risk Management, 2 Department of Preventive Medicine. Korea. Journal of Pharmacoepidemiology and Risk Management 2013;6:73-8.
- 3. Park JW. Severance Regional Pharmacovigilance Center, Department of Internal Medicine. Spontaneous Adverse Drug Reaction Reporting Program in Korea. JPERM 2008;1:20-4.
- 4. Choi DW, Choi MS, Ko AR. Current status of pharmaceutical safety management in Korea. J Korean Med Assoc 2012; 55(9):827-34.
-
- 5. Lee M. Monitoring Status of Pharmacy Drug Side Effects and Future Tasks. Journal of Pharmaceutical Policy Research Vol.11, No.2.
- 6. Choi YH, Sohn UD. The Surveillance of Adverse Drug Reaction (ADR) Reported Korean J Clin Pharm 2003;13(2):72-81.
- 7. Van Boxtel C, Santoso B, Edwards IR. Drug Benefits and Risks ? International Textbook of Clinical Pharmacology (2nd edition). eds. IOS Press, Amsterdam, 2008.
- 8. Pharmacovigilance: ensuring the safe use of medicines. WHO Policy Perspectives on Medicines Publications of the World Health Organization can be obtained from Marketing and Dissemination.
- 9. Chol NK, Park BJ. Adverse Drug Reaction Surveillance System in Korea, Journal of Preventive Medicine and Public Health 2007;40(4):278-84.
-
- 10. Yu YM, Choi SA, Lee MS, et al. The Clinical Characteristics of Adverse Drug Reactions Reported from the Community Pharmacy. Korean J Clin Pharm 2014;24(1):45-52.
- 11. Jeong SC. Promotion of Adverse Drug Reactions Report through Expansion of Drug Utilization Review. Journal of Korea Contents Association 2019;19(1):234-41.
- 12. Kim MS. Looking for the Status of Drug Side Effects and Activation of Monitoring. Journal of Korea Contents Association 2010;10(2).
 This Article
This Article
-
2019;5(1):56-65
Published on May 31, 2019
- Received on Apr 20, 2019
- Revised on May 15, 2019
- Accepted on May 17, 2019
 Services
Services
Shared
 Correspondence to
Correspondence to
- Minku Kang
-
*Corresponding author: College of Pharmacy, Woosuk University Wanju-Kun, Jeon-Buk 565-701, South KoreaTel: +82-63-290-1672, Fax: +82-63-290-1812
- E-mail: mkang@woosuk.ac.kr








