Original Article
Original Article - A Study on the Necessity of Additional Designation of Contraindications in Fixed-Dose Combination Drugs
Eun-Joo Lee1,3 and Joon Seok Bang2*
1Graduate School of Clinical Pharmacy, Sookmyung Women’s University
2College of Pharmacy, Sookmyung Women’s University
3Geongang-Nanoori Pharmacy- 복합성분제 중 병용금기 성분의 추가지정 필요성에 관한 연구
이은주1,3, 방준석2*
1숙명여자대학교 임상약학대학원, 2숙명여자대학교 약학대학, 3건강나누리약국
This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Purpose: Recently, combination drugs (CDs) are steadily increasing in the proportion of production, sales and prescription drug claims. However, as the CDs containing single drug with contraindication combinations are excluded often from the contraindication schedule, safety of the patients are greatly threatened. Methods: In this study, we compared the drug efficacies and side effects of each single drug with CDs which contain single drug with contraindication combinations. Also, we examined the reasons for the low contraindication in combination drugs in terms of content of active ingredient, timing of product launch, number of products, specificity of combination drug, and applicable range of contraindications. Results: The combination drugs are more likely to interact with the active ingredients that make up the combination drugs than single drug, the release timing is late, and the number of products is small, so it is thought that there will be fewer contraindications. Conclusion: The additional contraindications should be designated as soon as possible in CDs to enable safer use of CDs for patients with chronic diseases taking multiple drugs concurrently.
Keywords: Contraindication, Combination drug, Single agent, DUR, Korean FDA, Notification
우리나라는 인구의 고령화가 빠르게 진행되어 다수의 만성질환자 수가 증가함에 따라 2종 이상의 약효성분을 포함한 복합성분제의 생산, 매출규모가 커지고 있다.1) 복합성분제는 다수의 약물을 동시에 복용하는 환자에게 사용편의성과 복약순응도를 향상시키고 경제적 유익 때문에 선호되어,2) 처방의약품의 보험청구비중이 상승세이다.3,4) 하지만, 의사처방이 2종 이상 성분이 함유된 복합성분제로 변경되면, 현행 의약품안전사용서비스(Drug Utilization Review, DUR)5)로는 상호작용이나 부작용 발생을 적절히 예방하기 어려운 단점이 있다. 일례로 DUR의 임부금기에서 단일제에 해당하는 금기성분이 복합성분제에도 동일하게 적용되나6) 이를 제외한 ‘병용금기’, ‘특정연령대금기’, ‘주의’에서는 단일제에 적용되는 ‘금기’나 ‘주의성분’사항이 복합성분제에는 적용되지 않기 때문이다.7-9) 복합성분제는 한 종의 약물로 분류되지만 효과나 부작용 측면에서 각 성분의 약효를 모두 가지므로 여러 약물과 병용하면 부작용이 증가하거나 약효감소가 동일하게 발생한다.10) 하지만, 병용금기성분을 포함한 복합성분제라도 병용금기성분으로 지정되지 않은 경우가 많아 이를 복용하는 환자에서 치료실패나 심각한 부작용이 발생할 위험이 높다. 또한 복합성분제의 시장규모 확대,11) 복약순응도 향상, 경제적 장점, 개량신약 영역에서 복합성분제가 차지하는 비중12) 등을 다룬 연구는 많지만 금기나 주의해야 할 성분목록에서 제외된 복합성분제가 일으킬 수 있는 안전성 문제를 고찰한 연구는 많지 않다.
따라서, 본 연구는 병용금기성분에서 제외된 복합성분제가 야기하는 부작용이나 약효감소를 파악하여 이들을 병용금기성분으로 추가지정해야 할 필요성과 현행 제도 중 보완되어야 할 사항을 제안하기 위하여 실시하였다.
1. 연구설계
병용금기성분 조합을 가진 단일제를 포함하면서 병용금기성분에서 제외된 복합제를 대상으로 약효감소 또는 부작용 증가의 심각성을 조사하였다.
2. 연구대상 및 과정
2.1 복합제의 선정
식약처고시 제2017-86호에서 병용금기 성분13)으로 지정된 약물을 조사하였고, 이 중 생산 및 유통 중인 것은 KIMS 의약정보센터14)와 약학정보원15) 자료를 참고하여 선정하였다. 이어 병용금기 성분으로 지정된 단일제를 포함하면서도 병용금기성분에서 제외된 복합제를 선별하고,16) 이미 선별된 복합제 중 연구의 의미가 낮은 경우(국소작용제; 복합제에서 병용금기성분 조합 수가 단일제보다 많거나 같은 경우; 복합제 구성 약물이 3종 이상인 경우; 복합제 성분간 길항작용을 가진 경우; 복합제에서 적응증이 달라진 경우; 자료가 불충분한 경우)를 제외시키고 최종 연구대상을 선정하였다.
2.2 복합제와 단일제 간 부작용 및 약효 비교
단일제 A와 Z 약물은 병용금기성분이지만, 복합제 A&B와 Z 약물은 병용금기성분이 아닌 경우, 단일제에서 Z 약물과 병용 시 발생 가능한 상호작용(A↔Z)과 복합제에서 병용 시 발생 가능한 상호작용(A↔Z, B↔Z, A↔B)을 KIMS 의약정보센터와 약학정보원17), EpocratesR 자료18)를 조사하여 부작용 발생의 증가나 약효의 감소 정도를 비교하였다.
1. 복합제의 선정
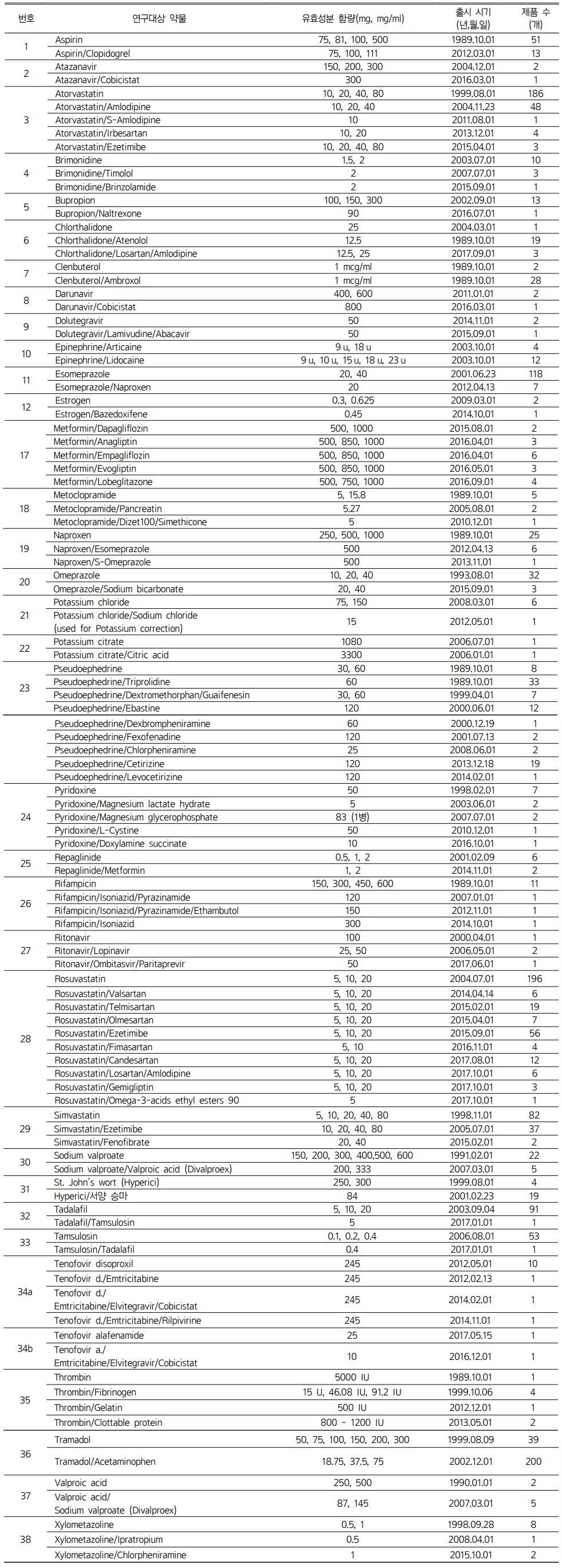
식약처고시 제2017-86호에서 병용금기성분으로 지정된 단일제를 포함하면서도 병용금기에서 제외된 복합제를 다음과 같이 선정하였다(Table 1).
4단계를 거쳐 연구대상 복합제로 선정된 89개를 단일성분을 기준으로 편의상 총 38개 군으로 재분류한 결과는 다음과 같다(Table 2).
2. 복합제와 단일제간 약효와 부작용 비교
복합제 중 병용금기성분으로 추가지정의 필요성을 파악하기 위하여 병용금기성분으로 지정된 단일제를 포함하면서 병용금기성분 분류에서는 제외된 복합제와 단일제 간 부작용의 발생증가 또는 약효의 감소 정도를 비교하였다. 연구대상 복합제는 총 89개이나 단일제와 비교하기 위해 38개 성분조합만 선별하여 비교했던 결과는 다음과 같다(Table 3).17,18)
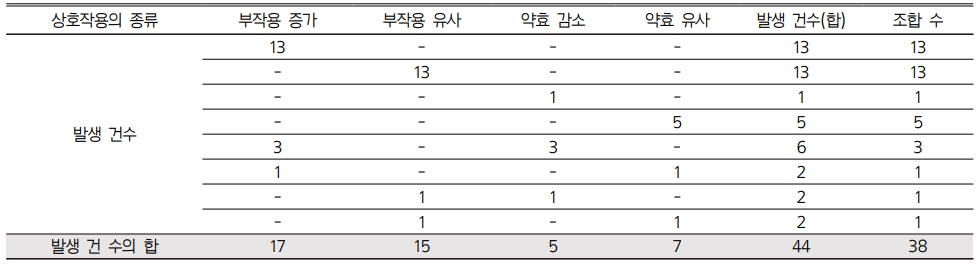
위 38개 조합이 야기하는 모든 상호작용을 부작용과 약효감소 측면에서 검토했을 때, 총 44건의 상호작용 중 복합제에서 단일제에 비해 부작용 발생이 증가했던 경우가 17건, 단일제와 유사한 정도로 증가한 경우는 15건, 단일제에 비해 약효가 더욱 감소했던 경우는 5건, 단일제와 유사한 정도로 감소한 경우가 7건이었다(Table 4).
3. 복합제에서 병용금기성분이 적은 이유
복합제가 단일제에 비해 부작용 증가나 약효감소가 더욱 심각했음에도 불구하고, 병용금기성분 지정에서 제외되었거나 또는 지정되었더라도 병용금기성분 조합이 단일제보다 적었다. 이에, 복합제에서 병용금기성분이 적은 이유로서 제품내 유효성분 함량, 제품출시시점, 제품 수, 복합제 특수성, 그리고 병용금기성분의 적용범위 측면에서 이들 요인이 병용금기 지정에 미친 영향을 분석하였다(Table 5). 단, 단일제는 tenofovir, alafenamide를 추가한 총 39개를, 복합제는 lamivudine, metformin, metoclopramide, simvastatin, tenofovir 복합제를 추가한 총 100개를 비교한 결과는 다음과 같았다(Table 5).
3.1 유효성분 함량
단일제 39개와 복합제 100개 유효성분 함량을 비교한 결과, 복합제 74개가 단일제의 함량범위 안에 있었는데, 17개는 단일제에 비해 함량은 낮으나 9개는 오히려 높았다. 단, 병용금기고시에는 성분명만 표시할 뿐 유효성분함량의 표시는 제한하지 않는다.
3.2 제품 출시시기
단일제 39개, 복합제 100개의 출시시기를19) 비교했을 때, 단일제의 평균적인 제품출시 시점은 1998년 12월이었으며, 복합제 제품의 평균적인 출시 시점은 이보다 14년 7개월이 지연된 2013년 7월이었다. 또한, 복합제 100개 중 93개는 단일제보다 출시가 늦었으며, 3개는 단일제와 같은 일자에 출시되었고 단 4개만 복합제가 먼저 출시되었다. 제품의 출시 시기가 병용금기 지정에 미치는 영향을 가장 잘 보여준 예는 metformin 복합제로서, metformin 단일제의 경우, 1989년 10월에 출시되어 2007년 4월에 병용금기성분으로 지정되었고, 이후 2010년까지 출시된 복합제 7종은 2011년 9월 병용금기성분으로 지정되었다. 하지만 2011년 이후 생산, 유통된 metformin 복합제는 14종에 이르나 현재까지도 병용금기성분으로 지정되지 않았다.
3.3 제품 수
단일제 및 복합제 139개를 비교했더니 복합제에서 단일제보다 제품 수가 많았던 조합은 100개 중 14개였다. 더구나 경구용 혈당강하제 metformin+glibenclamide, metformin+
glimepiride, 그리고 고혈압치료제인 chlorthalidone+atenolol은 단일제에 효과가 없으면 2차요법으로 사용하며 고혈압치료제 3제인 chlorthalidone+losartan+amlodipine은 2제 치료에도 효과가 없는 경우에만 사용하므로 단일제에 비해 복합제를 복용한 환자의 수는 예상보다 적을 수 있다.
3.4 복합제 특수성
38개 단일제의 평균적인 출시시점은 1998년 12월이었으나 병용금기성분으로 지정된 시점은 2009년 12월로 출시부터 병용금기지정까지 평균 11년이 소요되었다. 복합제는 단일제보다 상호작용이 복잡하므로 병용금기지정까지 소요되는 시간이 더 길어질 수 있다.
3.5 병용금기성분 적용범위
2016년도 식약처고시에서 병용금기성분의 적용범위는 별도의 표시가 없는 한 전신작용을 나타내는 제제로서 단일제에 한한다는20) 내용이 있었으나, 2017년 고시에서는 이 부분이 삭제되었다. 2017년 고시에서 병용금기성분으로 추가된 복합제는 새로 지정된 4개를 포함하여 총 9개로 이 중 병용금기성분 조합이 단일제와 같은 복합제가 1개, 단일제보다 많은 복합제는 1개였으며 나머지 7개 복합제에는 복합제 성분조합은 추가되었으나 단일제의 병용금기성분 조합에는 미치지 못하였다. 2017년 고시에서 병용금기성분의 적용범위는 변경되었으나, 실제로 병용금기성분에서 복합제와 복합제성분조합의 비중은 2016년 고시와 다르지 않았다. 하지만, 만약 2017년 고시의 병용금기성분에서 추가지정이 필요한 복합제가 모두 포함되었다면 병용금기약물 중 복합제가 차지하는 비중은 24.2%, 복합제성분조합의 비중은 41.6%로서 2017년 고시보다 2배 이상 증가했을 것이다(Table 6).
|
Table 2 Drugs for the first study |

주1) 병용금기 성분인 단일제를 기준으로 분류하였다. |
|
Table 3 Comparison of drug effects and side effects of the first study combination drugs and single agents |
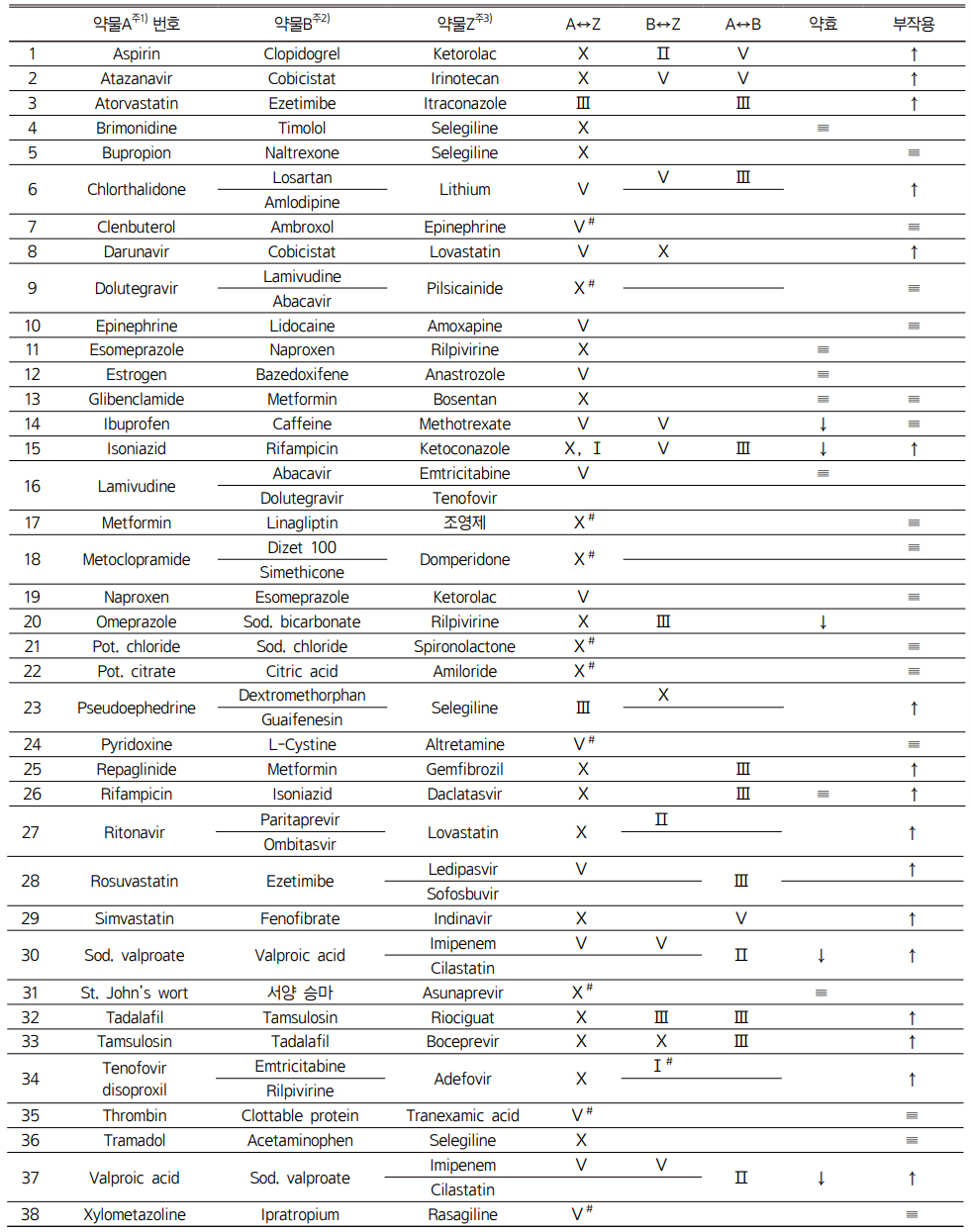
X주4), V주5), Ⅲ주6), Ⅱ주7), Ⅰ주8), ↓주9), ↑주10), ≡주11), #주12) |
|
Table 6 Comparison of contraindication ingredients of Korean FDA notification |
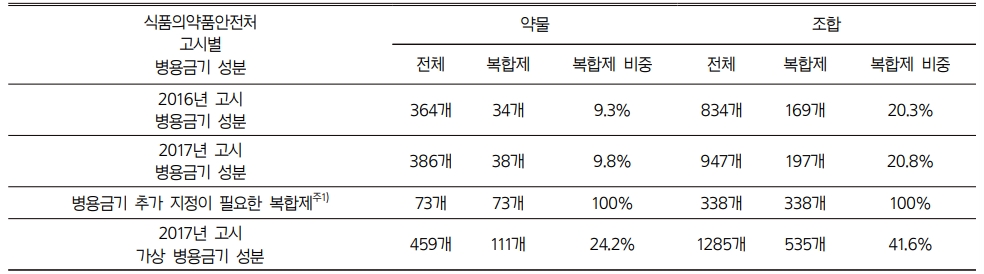
주1) 1차 연구대상 복합제 89개와 복합제 성분조합 342개에서 중복되는 복합제 8개와 복합제 성분조합 4개를 제외하면 실제 연구대상 복합제는 81개이며 복합제 조합은 338개이다(Table 6, 각주4, 각주5). 이 중 이미 병용금기성분으로 지정된 일부 조합을 포함하는 복합제주2) 8개를 제외하면 병용금기 추가지정이 필요한 복합제는 73개이며 복합제 성분조합은 338개이다. |
본 연구는 병용금기성분조합 상의 단일제를 포함하면서 병용금기에서 제외된 복합제가 가진 부작용의 증대 또는 약효감소의 문제점을 파악함으로써 복합제에서 병용금기성분이 추가 지정되어야 할 필요성을 제시하였다.
총 44개 상호작용 중 부작용 발생위험이 단일제에 비해 증가한 조합이 17개, 단일제와 유사한 조합이 15개였으며 약효가 단일제에 비해 더 감소되는 조합은 5개, 단일제와 유사하게 감소되는 조합이 7개로서 복합제에서 단일제보다 부작용 증가나 약효감소가 더욱 심각한 것으로 나타났으나 이들 복합제는 병용금기성분으로 지정되지 않으므로 단일제에서 복합제로 의사의 처방이 변경된다면 현행 DUR 프로그램에서는 그 문제사항을 발견하지 못한다. 따라서 최근 복합제의 생산 및 처방이 증가하는 경향을 고려한다면 복합제를 복용하는 환자의 안전한 약물사용을 위해 조속히 복합제에 병용금기성분 추가 지정이 필요하다.
복합제에서 단일제에 비해 병용금기성분이 적은 이유로 유효성분의 함량, 출시시기, 제품 수, 복합제의 특수성, 병용금기성분의 적용범위 측면에서 고찰하였을 때, 함량에 있어서는 복합제의 74%가 단일제의 함량범위 내에 있었으며, 병용금기고시에도 성분명만 명시할 뿐 유효성분의 함량을 제한하지 않으므로 유효성분의 함량이 복합제 병용금기 지정에 미치는 영향은 적을 것이다. 그리고, 병용금기성분의 적용범위는 2017년 고시에서 바뀌었으나, 복합제와 복합제 성분조합의 비중이 2016년과 크게 차이가 없는 것으로 보아 병용금기성분의 적용범위가 병용금기지정에 미치는 영향 또한 크지 않을 것으로 사료된다.
단일제의 경우 제품의 출시로부터 병용금기로 지정될 때까지 평균 11년이 소요되었다. 복합제는 단일제와 달리 복합제를 구성하는 각 약물간 상호작용이 나타날 수 있으므로 단일제보다 병용금기로 지정될 때까지의 연구가 더 필요하다.
복합제는 단일제에 비해 출시가 평균 14년 7개월이 늦은 점을 감안하면 상대적으로 신약이다. 단일제에서 제품출시에서 병용금기 지정까지 평균 11년이 소요된 것과 복합제 출시가 아직 5년 미만인 약물이 다수인 점을 감안해 보면 복합제에서 출시시기가 병용금기 지정에 영향을 끼쳤음을 짐작할 수 있다.
복합제에서 단일제보다 제품 수가 많은 조합은 14%에 그쳤다. 게다가 복합제는 단일제에 효과가 없는 경우 2차요법으로 사용되는 경우가 많으므로 단일제에 비해 환자수가 적어 부작용 발생가능성도 적을 수 있다.
식약처에 병용금기성분 조합이 있는 단일제를 포함하는 복합제에서 병용금기성분이 적은 이유를 문의했는데, 응답이 병용금기 대상품목을 5개년 계획으로 정한 다음 제품 하나하나를 제품설명서의 적응증을 기준으로 판정한다고 하였다. 현재 유통, 생산 중인 45,000개 이상의 의약품21)을 식약처 의약품안전국 산하 의약품안전평가과22) 직원 10여명이 모두 평가하기는 무리라고 판단된다.
선행연구에서 의약품시장에서 복합제의 생산 및 매출 증가1), 처방의약품의 청구금액에서 복합제의 비중증가3), 복합제의 복약순응도 향상 및 경제적 장점2), 개량신약에서 복합제의 비중12) 증가 등 복합제의 장점만을 주로 다룬데 비해 본 연구는 병용금기성분조합이 있는 단일제를 포함하는 복합제에서 병용 시 부작용 발생 또는 약효감소 가능성과 같은 복합제의 문제점을 다루었다는데 의의가 있다. 2009년 ‘감사결과 처분요구서10)에도 금기성분이 포함된 복합성분 의약품이 위험성은 있으나 사용기준을 제공하지 않은 것에 대한 언급이 있었다. 하지만, 본 연구는 병용금기성분조합을 포함하는 복합제의 위험성을 인지하고 실제로 복합제와 단일제의 병용 시 부작용 증가 또는 약효감소를 비교하여 근거를 제시하였다. 또한 본 연구는 병용금기뿐만 아니라 특정연령대금기 및 주의성분이 있는 단일제를 포함하면서도 금기로 지정되지 않고 있는 복합제에 대한 검토계기를 제공했다는 점이 의의가 있다.
하지만, 본 연구는 병용금기성분조합이 있는 단일제를 포함하면서 병용금기에서 제외된 복합제만을 연구대상으로 한 것이므로 모든 복합제에 적용되지 못한 제한점이 있다. 그리고, 이들 복합제를 분류 시 편의상 단일제를 기준으로 하였으므로 1차 연구대상에 포함된 복합제와 복합제성분조합에 중복 포함된 경우가 있다. 또한, 생산・유통되는 제품만을 선별하였으므로 병용금기 이후에 출시된 제품도 있었다. 이는 예외적으로 현재 생산, 유통되지 않는 초기 출시 제품과 출시시기를 비교하였다.
단일제에 비해 복합제는 병용금기성분지정에서 제외된 경우가 많아 단일제에서 복합제로 처방변경시 현행 DUR 프로그램으로써 예방하는 것이 곤란하다. 이에 식약처는 현재 병용금기성분 조합을 가진 단일제를 포함하는 복합제에서도 병용금기성분을 추가로 지정하기를 제안한다. 또한 신규 허가될 복합제도 병용금기를 고려하고, 이후 단일제에서 병용금기성분의 추가 지정이 필요하다면 단일제를 포함하는 복합제에서도 병용금기성분의 지정이 필요하다. 단일제에서 복합제로 처방이 변경되더라도 병용금기정보가 그대로 반영되어 부작용 발생이나 약효감소없이 안전하게 복합제가 사용되고, 특정연령대 금기와 주의의약품에서도 복합제 연구가 심도있게 진행된다면 복합제가 다양한 연령층에서 보다 안전하게 활용될 것이다.
- 1. 김소희. 복합제가 대세다(헬스포커스 2015년 10월 23일) (2017년 11월 5일 인용 http://www.healthfocus.co.kr/news/articleView.html?idxno=52275).
- 2. 곽수연. 국내외 복합제 개발 동향 및 전망(의학신문 2009년 5월 25일)(2018년 4월 10일 인용 http://www.bosa.co.kr/news/articleView.html?idxno=2019242).
- 3. 통계청. 단일제/복합제 청구현황(건강보험, 2017년 7월 13일) (2018년 4월 10일 인용, http://kosis.kr/statHtml/statHtml.do?orgld=354&tblld=DT_3540 04N_021).
- 4. 건강보험심사평가원. 2017 급여의약품 청구 현황. (2018년 6월 29일 인용, http://www.hira.or.kr/ebooksc/ebook_477/ebook_477_201806041037009230.pdf).
- 5. 건강보험심사평가원. 의약품안전사용서비스(DUR) 바로가기 (2018년 7월 4일 인용, https://www.hira.or.kr/rg/dur/form.do?pgmid=HIRAA030033000000).
- 6. 식품의약품안전처. 식품의약품안전처 고시 제2016-155호, 의약품 병용금기성분 등의 지정에 관한 규정 일부개정고시 제6조 임부금기 성분 (2017년 1월 21일 인용, http://www.mfds.go.kr/index.do?mid=687&seq=11499&cmd=v).
- 7. 식품의약품안전청. 식품의약품안전청공고 제2009-300호, 병용금기, 연령금기 의약품 추가성분 공고(2010년1월28일((2018년 7월 1일 인용, http://www.mfds.go.kr/index.do?mid=1043&seq=2949&cmd=v).
- 8. 식품의약품안전처. 코데인 함유 의약품 안전사용을 위한 안전성 서한, 2015년 4월 30일 (018년 6월 30일 인용, http://www.mfds.go.kr/index.do?mid=676&seq=27352&cmd=v).
- 9. 식품의약품안전처. 진해 거담제‘디히드로코데인’함유 의약품 허가사항변경, 2018년 1월 11일 (018년 6월 30일 인용, http://www.mfds.go.kr/index.do?mid=676&seq=40202&sitecode=1&cmd=v).
- 10. 건강과 대안. 서울특별시 감사결과 처분요구서; 2013년 2월 24일 (2017년 11월 3일 인용, http://www.chsc.or.kr/?post_type=reference&p=3739).
- 11. 천승현. 처방실적으로 확인된 제약사들의 복합제 짝사랑 이유, 바이오스펙테이터 2017년 8월 9일 (2018년 2월 24일 인용, http://www.biospectator.com/view/news_view.php?varAtcId=3746).
- 12. 김용주. 개량신약 93품목 허가. 3개 중 1개는 ‘고혈압치료제.’약업신문 2018년 2월 26일 (2018년 4월 10일 인용, http://www.yakup.com/news/index.html?mode=view&nid=215434).
- 13. 식품의약품안전처. 식품의약품안전처고시 제2017-86호, 의약품 병용금기 성분 등의 지정에 관한 규정 일부개정고시, 병용금기 성분; 2017년 11월 6일 (2017년 11월 7일 인용, http://www.mfds.go.kr/index.do?mid=686&pageNo=2&searchkey=title:contents&cmd=v&seq=13470).
- 14. KIMS 의약정보센터. 유통/생산 ㅋ중인 의약품; 1987년(2018년 1월 7일 인용, http://kimsonline.co.kr).
- 15. 약학정보원. 생산/수입 실적이 있는 품목; 2000년 (2018년 1월 7일 인용, http://www.health.kr/).
- 16. KIMS 의약정보센터. 의약품 검색; 1987년(2018년 3월 12일 인용, http://kimsonline.co.kr).
- 17. 약학정보원. 상호작용; 2000년 (2018년 3월 12일 인용, http://www.health.kr/).
- 18. Epocrates Online. Athenahealth, Inc. Interaction Check; c2018 (cited 2018 Mar 12, Available from http://online.epocrates.com/).
- 19. KIMS 의약정보센터. 약가이력정보; 1987년(2018년 3월 23일 인용, http://kimsonline.co.kr).
- 20. 식품의약품안전처. 식품의약품안전처고시 제2016-155호, 의약품 병용금기 성분 등의 지정에 관한 규정 일부개정고시 제2조(적용범위); 2016년 12월 30일 (2017년 1월 21일 인용, http://www.mfds.go.kr/index.do?mid=686&seq=11499&cmd=v).
- 21. 약학정보원. Current Data Status(의약품 상세보기), 2000년 (2018년 5월 22일 인용, http://www.health.kr/).
- 22. 식품의약품안전처. 조직도. 부서. (2018년 5월 22일 인용, http://www.mfds.go.kr/index.do?mid=750).
 This Article
This Article
-
2021;7(1):1-12
Published on May 31, 2021
- Received on May 12, 2021
- Revised on May 25, 2021
- Accepted on May 26, 2021
 Services
Services
Shared
 Correspondence to
Correspondence to
- Joon Seok Bang
-
Rm. 308, College of Pharmacy, Sookmyung Women’s University, Cheongpa-ro 47-gil 100, Yongsan-gu, Seoul 04310, Republic of Korea
Tel: +82-2-2077-7526, Fax: +82-2-710-9799 - E-mail: jsbang@sm.ac.kr