Clinical Information
Clinical Information - Paxlovid (nirmatrelvir/ritonavir): the First Oral Antiviral Treatment for COVID-19
Moonui Kim#, Jieun Kim#, Dong Jun Lee#, Sang Jin Chang#, Hey Young Jeong#, Haeun Ji#, and Yun Jeong Lee*
College of Pharmacy, Dankook University
- 팍스로비드(nirmatrelvir/ritonavir): 코로나바이러스감염증-19에 대한 최초의 경구 항바이러스 치료제
김무늬#, 김지은#, 이동준#, 장상진#, 정혜영#, 지하은#, 이윤정*
단국대학교 약학대학
This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Paxlovid (nirmatrelvir/ritonavir) is the first oral antiviral medication approved under the emergency use authorization for the treatment of COVID-19. In South Korea, it is approved for the treatment of mild to moderate COVID-19 confirmed adults and children over 12 years weighing at least 40 kg who are at high risk for progression to severe COVID-19. The primary clinical data supporting the approval of nirmatrelvir/ritonavir is EPIC-HR, a phase 2-3, double-blind, randomized controlled trial in which nirmatrelvir/ritonavir resulted in reduction of COVID-19 related hospitalization or death by 88% compared to placebo. However, nirmatrelvir/ritonavir has potential for various significant drug-drug interactions, and adverse events such as impaired sense of taste, diarrhea, and muscle aches which warrant careful monitoring and counseling by the pharmacists.
Keywords: Paxlovid, Nirmatrelvir/ritonavir, COVID-19, Drug interaction, Medication counseling
코로나바이러스감염증-19(COVID-19)는 SARS-CoV-2를 원인 병원체로 하는 중증 호흡기 증후군으로, 사람간 비말 전파 또는 에어로졸 발생시 공기 전파에 의해 발생된다. COVID-19는 2019년 12월 8일 중국 후베이성 우한시에서 처음 나타났으며 환자 집단에서 폐렴과 유사한 증상을 일으켰고,1) 2019년 발병 이후 COVID-19는 전 세계의 건강을 계속 위협하고 있다. 대부분의 COVID-19환자는 경미한 증상을 보이지만 일부 환자는 심각한 증상을 경험하거나 사망할 수 있다. 특히 고령자, 흡연자, 비만, 심혈관계 질환 및 암과 같은 특정 특성이나 기저질환을 가진 사람이 COVID-19에 감염된 경우 그 위험이 더 높을 수 있다.2)
COVID-19를 극복하기 위해 다양한 진단, 백신, 약물이 개발되었고 계속 연구 중에 있다. Real-time reverse transcription (RT)-PCR 기반의 진단 도구는 COVID-19 팬데믹 초기에 개발되었으며 검사, 추적 및 환자 격리를 위해 시급히 사용되었다. COVID-19의 원인 병원체인 SARS-CoV-19를 확인한 뒤 mRNA 백신, 바이러스 매개 백신과 같은 백신도 1년 만에 새로운 플랫폼 기술을 이용하여 개발에 성공하였다. 치료제 개발은 약물의 용도변경, 회복기 혈장 요법, 단일클론항체 개발과 같이 다양한 방식으로 진행되어 왔다.3) 지금까지 개발되어 국내/외에서 승인된 COVID-19 치료제에는 remdesivir (베클루리), regdanvimab (렉키로나), molnupiravir (라게브리오), nirmatrelvir/ritonavir (팍스로비드) 등이 있다.
위에서 언급된 치료제 중 remdesivir와 regdanvimab는 주사제이며, molnupiravir와 nirmatrelvir/ritonavir는 경구용 치료제이다. Remdesivir는 adenosine nucleotide 전구체로 그 대사체가 ATP의 유사체로 작용하여 RNA 복제 과정에 관여하여 항바이러스 효과를 나타내게 된다.4) Remdesivir는 PCR 검사 등을 통해 COVID-19가 확진된 성인 및 소아(12세 이상이고 40 kg 이상) 환자로서, 폐렴, 실내공기에서 산소포화도가 94% 이하인 환자, 보조산소 치료가 필요한 환자, 또는 비침습적 또는 침습적 기계환기나 체외막산소요법이 필요한 환자 중 하나 이상에 해당하는 자를 대상으로 국내에서 긴급사용 승인이 된 약물이다.5) Regdanvimab은 유전자 재조합 항체 치료제로서 PCR 검사 등을 통해 COVID-19가 확진된 성인 환자로, 실내 공기에서 산소포화도가 94%를 초과하는 자, 보조적인 산소 공급이 필요하지 않은 자, 그리고 투여 전 7일 이내 증상이 발현한 자에 모두 해당하는 고위험군 경증 및 모든 중등증 환자를 대상 환자군으로 국내에서 승인이 결정되었다.5) 2022년 3월 23일 nirmatrelvir/ritonavir에 이어 국내에서 두 번째로 긴급사용 승인이 결정된 경구용 치료제인 molnupiravir는 그 대사체가 SARS-CoV-2의 RNA에 삽입되어 복제를 억제하여 항바이러스 효과를 나타내게 된다.6,7) Molnupiravir는 COVID-19 검사를 통해 확진된 환자로서, 중증으로 진행될 위험이 높은 경증 및 중등증 성인 환자의 치료에 승인을 받았다.6) 단, 다른 COVID-19 치료제를 사용할 수 없거나 다른 치료제가 임상적으로 적절하지 아니한 환자에 한하여 사용되어야 함으로 사용이 제한되었다.6)
마지막으로 nirmatrelvir/ritonavir는 국내에서 첫 번째로 승인된 경구용 COVID-19 치료제이다. 2021년 12월 FDA는 SARS-CoV-2의 주요 프로테아제 저해제인 nirmatrelvir와 HIV-1 프로테아제 저해제이며 CYP3A저해제인 ritonavir를 포함하는 nirmatrelvir/ritonavir (팍스로비드)의 긴급사용 승인을 발행하였다. 대상 환자군은 입원 또는 사망을 포함하여 중증 COVID-19로 진행될 위험이 높으며, COVID-19 검사 결과에서 양성결과가 있는 경증-중등증 성인 및 소아 환자(12세 이상이며 체중 40 kg 이상)였다.8) 국내에서는 2021년 12월 22일 질병관리청에서 식약처에 긴급사용 승인을 요청했으며 12월 27일 식약처에서 긴급사용 승인을 결정하였다. 이러한 결정은 COVID-19 확진자 및 중증의 환자가 증가하는 상황 속에서 경구용 치료제 도입의 필요성, 의료진의 선택권 및 안전성과 효과성 검토 결과 등을 종합적으로 고려하여 결정되었다.9) Nirmatrelvir/ritonavir 긴급 승인의 대상 환자군은 PCR 검사 등을 통해 COVID-19가 확진된 환자로서, 중증으로 진행될 위험이 높은 경증 및 중등증 성인 및 소아 환자(12세 이상이며 체중 40 kg이상)이다. Nirmatrelvir/ritonavir는 중증의 COVID-19 환자의 치료, COVID-19의 사전 노출 또는 노출 후 예방에 대한 효과, 연속 5일보다 긴 기간의 사용효과가 입증되지 않았기 때문에 이에 대해서는 FDA와 식약처에서 모두 사용을 제한했다.8,9) 본 고에서는 nirmatrelvir/ritonavir의 소개와 더불어 임상 연구와 데이터 및 허가사항에 대해 더 자세하게 다뤄보고자 한다.
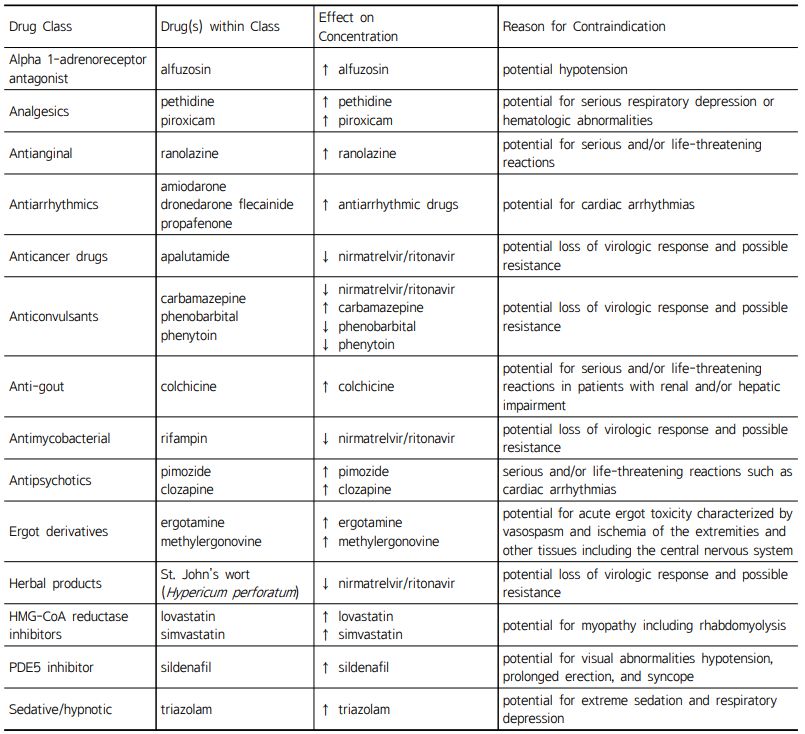
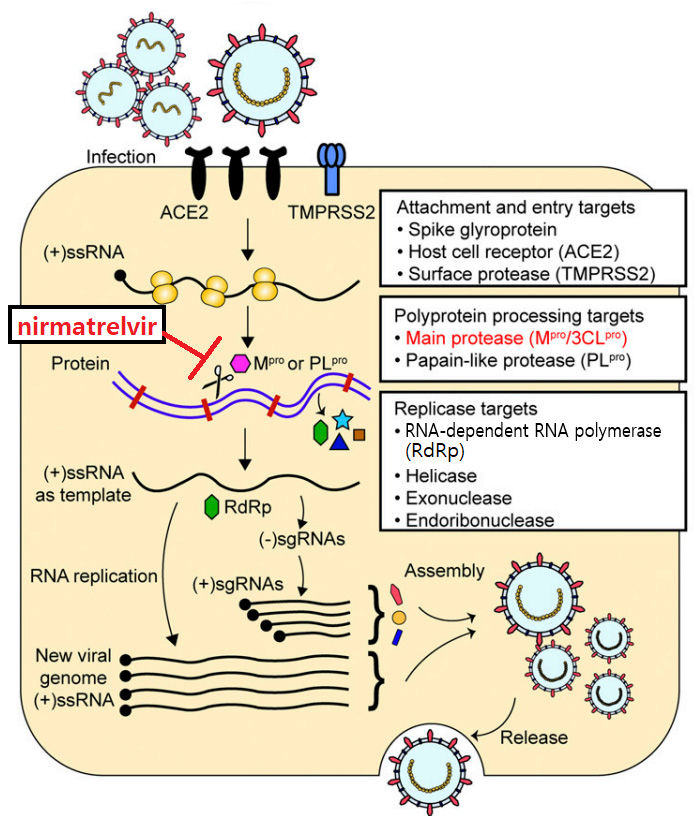
Nirmatrelvir의 작용기전은 SARS-CoV-2 바이러스의 생활사(Fig. 1)를 통해 이해할 수 있다. 바이러스의 RNA가 세포 내로 유입되면, 가장 먼저 숙주의 번역체계를 통해 polyprotein 덩어리를 만든다.11) 이들 덩어리는 바이러스 유래 단백질분해효소인 MPRO (또는 3CLPRO, 3C-like protease)와 PLPRO (papain-like proteinase)에 의해 여러 단백질 조각으로 가공되고, 가공된 단백질들의 일부가 RNA 중합효소인 RdRp (RNA-dependent RNA polymerase)를 형성한다.11) 이러한 SARS-CoV-2 바이러스의 복제 과정 중에서 nirmatrelvir는 MPRO (또는 3CLPRO)를 억제한다.13) Nirmatrelvir는 Fig. 2를 통해 구조적으로 펩타이드 모방체임을 알 수 있으며, 분자 내 nitrile기를 통해 MPRO 활성부위의 cysteine 잔기에 가역적으로 공유 결합한다.13,14) 따라서 nirmatrelvir를 MPRO 효소의 경쟁적 저해제로 볼 수 있다. 이 cysteine 잔기는 다른 코로나 바이러스 종의 MPRO 에도 존재하는 것으로서, nirmatrelvir가 다양한 변종(예: SARS-CoV-2 Omicron)에도 잠재적인 억제력을 가지는 것으로 보고 있다.15-17) SARS- CoV-2 MPRO 가 억제되면 polyprotein을 가공할 수 없게 되고, 이는 바이러스 유전체의 복제와 전사에 관여하는 RNA 중합효소인 RdRp (RNA-dependent RNA polymerase) 형성을 방지한다.15,16,18) 이로써 SARS-CoV-2 바이러스의 첫 숙주 감염 이후의 추가 증식이 저해된다.
Ritonavir는 기존의 HIV/AIDS를 치료하기 위해 다른 약물과 병용되는 항레트로바이러스 약물 중 하나로 HIV protease 억제제로서 개발된 바 있다.19) 그러나 현재는 자체적인 항바이러스 활성을 위해서는 거의 사용되지 않고, 여러 protease 억제제의 부스터로 널리 이용된다.19) Ritonavir는 장, 간 및 신체의 다른 조직에서 cytochrome P450 (CYP) 3A4를 억제하여,19,20) 일반적으로 해당 효소에 의해 대사되는 protease의 체내 반감기를 증강시킨다. 이를 통해, ritonavir는 nirmatrelvir의 혈중농도 유지에 유의미한 도움을 줄 수 있다.
|
Fig. 1 Several drug development targets and points of action of nirmatrelvir in the mechanism of host infection and propagation of SARS-CoV-2 virus10) |
|
Fig. 2 Molecular-structural interaction of MPRO enzyme and nirmatrelvir |
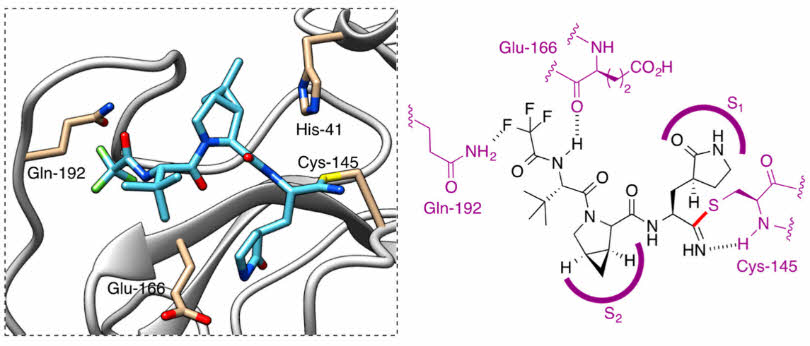
Nirmatrelvir/ritonavir의 약물동력학적 특성은 건강한 피험자를 대상으로 연구된 바 있다.8,21) 연구에서는 공복 상태의 건강한 피험자에게 150 mg nirmatrelvir 단독 투여의 평균 반감기(t1/2)가 약 2시간이었던 것에 비해 250 mg/100 mg nirmatrelvir/ritonavir의 단회 투여 후의 평균 반감기(t1/2)는 약 7시간으로 증강되었다.21) 이를 통해 ritonavir가 nirmatrelvir 전신 농도를 증가시키는 약동학적 증강제로서 작용했음을 알 수 있었다. 또한, nirmatrelvir/ritonavir를 75 mg/100 mg, 250 mg/100 mg 및 500 mg/100 mg 농도 조합으로 1일 2회 반복 투여했을 때, 정상상태(steady-state)에서 전신 노출의 증가는 용량 비례 예상 수치보다 낮은 값을 보였다.8,21) 10일에 걸친 다중 투여는 대략 2일째에 정상상태를 달성하였다.8,21) 이때 5일차의 전신 노출은 모든 용량에 걸쳐 10일차 값과 유사했다.21) Nirmatrelvir/ritonavir의 약동학적 특성 수치는 Table 1에 기술되어 있다.
흡수
Nirmatrelvir/ritonavir 300mg/100mg을 단일 용량으로 경구 투여한 후, nirmatrelvir의 Cmax는 2.21 µg/mL이었다. 0에서 무한대 시점까지의 혈장 농도-시간 곡선하 면적(AUCinf)은 23.01 µg*hr/mL 이었다.21) Cmax (Tmax)까지의 중앙값(범위) 시간은 3.00시간(1.02-6.00)이었고, 산술 평균(±SD) 최종 제거 반감기는 6.1(1.8) 시간이었다.21) 같은 투여조건에서 ritonavir의 Cmax는 0.36μg/mL 및 AUCinf는 3.60 µg*hr/mL 이었다. Cmax (Tmax)까지의 중앙값(범위) 시간은 3.98시간(1.48-4.20)이었고, 최종 제거 반감기의 산술 평균(±SD)은 6.1(2.2)시간이었다(Table 1).21)
경구 흡수에 대한 음식의 영향으로 고지방 식사와 함께 투여하면, ritonavir 정제와 nirmatrelvir의 현탁 제제를 병용 투여한 조건에서 공복 상태에 비해 nirmatrelvir의 노출이 약간 증가했음을 알 수 있었다(평균 Cmax에서 약 15% 증가 및 평균 AUClast에서 1.6% 증가).21)
분포
사람의 혈장에서 nirmatrelvir의 단백질 결합율은 약 69%였고, 같은 조건에서 ritonavir의 단백질 결합은 약 98-99%으로 나타났다(Table 1).21)
대사
Ritonavir를 병용하지 않고 nirmatrelvir를 평가한 시험관 내 연구에서 nirmatrelvir가 주로 CYP3A4에 의해 대사되는 것으로 밝혀졌다. 또한 nirmatrelvir/ritonavir 투여는 nirmatrelvir의 대사가 억제됨을 보여주었다.8) 이는 사람의 혈장에서 관찰된 절대 다수의 약물 관련 물질이 대사되지 않은 nirmatrelvir였음을 통해 확인할 수 있었다. 그밖에 nirmatrelvir의 소량의 산화 대사 산물이 대변과 소변에서 관찰되었다.21)
Ritonavir을 방사성으로 표지 시켜서 단일로 경구 600 mg 투여 후, 혈장에서 발견된 거의 모든 방사성 표지는 대사되지 않은 ritonavir였다.21) 사람에게서 4가지 ritonavir 대사산물이 확인되었는데, isopropyl thiazole oxidation metabolite (M-2)이 주요 대사 산물이었다. M-2 대사 산물의 AUC는 모체 약물 AUC의 약 3%였다.21) 사람의 간 microsome을 활용한 연구에서 CYP3A4가 ritonavir 대사에 관여하는 주요 동형이지만 CYP2D6도 M-2의 생성에 기여한다는 것이 입증되었다. 이러한 ritonavir의 대사 산물은 주로 대변에서 제거되었다.21)
제거
Ritonavir와 함께 투여된 nirmatrelvir의 주요 제거 경로는 모체 분자 기준으로 신장 배설이었다. Nirmatrelvir 300 mg 투여량의 약 49.6%와 35.3%가 각각 소변과 대변에서 회수되었다(Table 1). Nirmatrelvir 모체 분자가 가장 주요한 배설물 내 약물 관련 물질이었고, 기타 배설물 속에서 가수분해 반응으로 인해 소량의 대사산물이 발생하는 경우가 있었다.21)
Ritonavir을 방사성으로 표지 시켜 사용한 사람 대상 연구에서 ritonavir의 제거가 주로 간담도계를 통해 이루어졌다는 것이 입증되었다.21) 방사성 표지의 약 86%가 대변에서 회수되었으며 그 중 일부는 흡수되지 않은 ritonavir일 것으로 예상된다.
|
Table 1 Pharmacokinetic parameters of nirmatrelvir and ritonavir in healthy subjects |
a 건강한 대상자에서 100 mg ritonavir tablet과 함께 300 mg nirmatrelvir tablet (2정 x 150 mg)를 단회 투여한 후의 자료 |
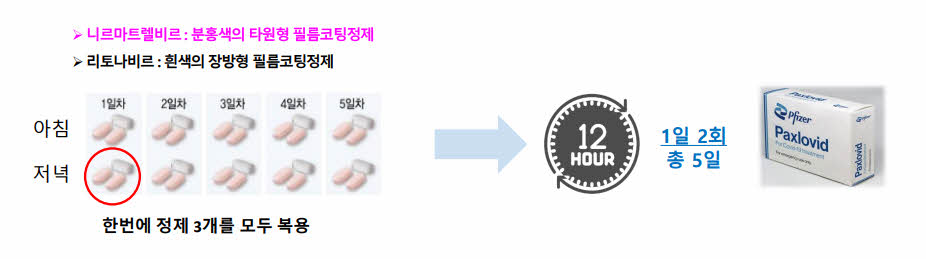
Nirmatrelvir/ritonavir는 타원형 분홍색의 필름 코팅 정제인 nirmatrelvir 정(nirmatrelvir 150 mg)과 흰색의 장방형 필름 코팅 정제인 ritonavir 정(ritonavir 100 mg)으로 구성되어 있다.22,23) Nirmatrelvir 300 mg(150 mg 2정)과 ritonavir 100 mg(100 mg 1정)은 함께 복용하며 1일 2회로(12시간마다) 5일 동안 경구 투여한다. 만약 ritonavir와 동시에 병용 투여하지 않을 경우, nirmatrelvir는 치료적 효과를 위해 필요한 혈중농도에 충분하게 도달하지 못한다.
이 약은 COVID-19 양성 판정을 받고 증상발현 후 5일 이내에 투여가 시작되어야 하며 바이러스 제거를 최대화하고 COVID-19의 전파를 최소화하기 위해 5일간의 전체 치료 과정을 완료하고 공중 보건 권고에 따라 격리를 유지하는 것이 중요하다. 환자가 이 약으로 치료를 시작한 후 COVID-19로 인해 입원할 경우일지라도 전체 5일간의 치료 과정을 완료해야 한다.
경증의 신장애 환자와 경증 또는 중등도의 간장애 환자에서 용량조절은 필요하지 않다. 중등도의 신장애(eGFR ≥30~<60 mL/min) 환자에서, nirmatrelvir/ritonavir의 용량은 nirmatrelvir 150 mg과 ritonavir 100 mg을 1일 2회 5일간 투여로 감량한다. 중증의 신장애, 간장애 환자에서 nirmatrelvir/ritonavir의 적절한 투여용량은 확립되지 않았으므로 중증의 신장애, 간장애 환자에게는 nirmatrelvir/ritonavir가 권장되지 않는다.8)
EPIC-HR (Evaluation of protease inhibition for COVID- 19 in high-risk patients)2)
화이자에서 2022년 완료한 EPIC-HR 연구에서는 중증 코로나바이러스 질환으로 진행될 위험이 높고, 백신 접종을 받지 않았으며 입원하지 않은 COVID-19 감염 증상이 있는 성인을 대상으로 제2/3상, 무작위, 이중 맹검, 위약 대조시험을 수행하여 nirmatrelvir/ritonavir의 안정성과 효능을 평가했다(Table 2).2) 임상시험 대상자는 당뇨병, 과체중(BMI≥25 kg/m2), 만성 폐질환(천식 포함), 만성 신장질환, 현재 흡연자, 면역억제성 질환 또는 면역억제 치료, 심혈관계 질환, 고혈압, 활동성 암 등의 중증 질환으로의 진행 가능성 위험인자를 한가지 이상 가지고 있는 만 18세 이상의 성인이거나, 이런 동반 질환에 관계없는 60세이상의 고령 환자였다. 참여자들은 미국, 불가리아, 남아프리카, 브라질, 인도, 멕시코, 우크라이나, 터키, 일본, 스페인, 러시아, 아르헨티나, 콜롬비아, 폴란드, 한국 등의 의료기관을 통해 모집되었다. 시험 약 투여시작 이전 5일 내에 COVID-19 증상이 발현된 대상자가 시험에 포함되었고, 이전 COVID-19 감염 또는 백신접종의 이력이 있는 사람은 이 시험에서 제외되었다. 대상자는 무작위 배정되어(1:1) 5일동안 매12시간마다 nirmatrelvir 300 mg/ritonavir 100 mg 또는 위약을 경구 투여했다. 총 2,246명의 환자 중 1,120명은 nirmatrelvir/ritonavir그룹으로 1,126명은 위약 그룹으로 나뉘었고, 평균 연령은 만 46세였으며, 51%는 남성, 72%는 백인, 14%는 아시아인이었다. 중증 COVID-19로 진행될 위험과 관련된 공존 조건은 BMI 25 kg/m2 이상(1,807명, 80.5%), 현재 흡연자(876명, 39.0%), 고혈압(739명, 32.9%)이다. 대상자 중 66%는 시험 약 투여시작 이전 3일 이내에 증상이 발현되었으며, 대상자 중 47%는 베이스라인의 혈청학적 검사에서 음성이었다. 평균 베이스라인 바이러스 부하는 4.63 log10 copies/mL이었고, 26%는 베이스라인에서 바이러스 부하가 107 copies/mL 이상이었다. 대상자 중 6% 무작위 배정 시 단일 클론 항체치료를 받고 있거나 받을 것으로 예상되어 분석에서 제외되었다. 인구학적 특성과 질병특성은 nirmatrelvir/ritonavir 투여군과 위약군 간에 유사하게 구성되었다.
EPIC-HR 연구의 일차 평가변수는 28일까지의 COVID-19 관련 입원 또는 사망(원인 불문) 환자의 비율이며, 바이러스 부하 변화, 약물 부작용 발생률은 이차 평가변수에 해당한다. 연구는 중간 분석군(증상 발병 후 3일 이내 치료)과 최종 분석군(증상 발병 후 5일 이내 치료)을 대상으로 분석을 수행하였다. 중간분석 결과 COVID-19 관련 입원을 하거나 모든 원인으로 사망한 발생률은 nirmatrelvir/ritonavir 투여군에서 0.77%, 위약 투여군에서 7.01%로 -6.32% 차이(95% CI, -9.04~-3.59, P<0.001)를 보였다. 최종분석 결과에서 nirmatrelvir/ritonavir 투여군에서 0.72%, 위약 투여군에서 6.45%로 -5.81% 차이(95% CI, -7.78~-3.84, P<0.001)를 보여 nirmatrelvir/ritonavir 투여군의 입원율은 89% 감소했으며, 치료 집단의 사망은 발생하지 않았다. 총 13명의 사망은 모두 위약군에서 발생했다. 또한 nirmatrelvir/ritonavir 투여군에서 위약군에 비해 바이러스 부하가 0.868±0.105 log10 copies/mL (95% CI, –1.074 to –0.6615; P<0.001) 감소하였다. 약물 이상 반응은 두 집단에서 비슷하게 발생하였고(nirmatrelvir/ritonavir 22.6%, 위약 23.9%), 심각한 이상 반응은 위약군에서 높게 발생하였다(1.6%, 6.6%). 미각이상(5.6%, 0.3%)과 설사(3.1%, 1.6%)는 nirmatrelvir/ritonavir 투여군에서 높게 발생하였다. EPIC-HR 연구는 다양한 나라의 환자가 참여했으며, 중증 COVID-19로 진행될 위험이 높은 집단이 포함되었음에도 해당 인구통계학적 및 임상적 특징이 실제 인구 통계와 유사한 강점을 가진다. 그러나 해당 연구 집단은 백신접종을 받지 않은 사람으로 제한되어 있어 이를 보완한 후속 연구인 EPIC-SR, EPIC-PEP이 진행중에 있다. EPIC-HR 연구 결과는 COVID-19 감염 초기에 nirmatrelvir와 ritonavir를 함께 사용하면 중증 질환으로의 진행을 감소시키고 바이러스 부하를 빠르게 감소시킬 수 있음을 시사한다.
EPIC-SR (Evaluation of protease inhibition for COVID-19 in standard-risk patients)24)
화이자는 EPIC-HR 연구에 이어 표준 위험군을 대상으로 nirmatrelvir/ritonavir의 효능과 안정성을 평가하는 EPIC-SR 연구를 진행중이며 21년 12월 중간 분석 결과를 발표하였다. EPIC-SR 연구에는 COVID-19으로 인한 입원 위험이 낮은 백신 미접종 성인과 COVID-19 감염 시 중증 위험군이 될 수 있는 위험 요소를 1개 이상 가진 백신 접종 성인이 포함되었다. 참여자들은 미국, 아르헨티나, 브라질, 헝가리, 불가리아, 스페인, 터키, 우크라이나, 일본, 한국, 대만, 태국, 멕시코, 남아프리카공화국 등의 의료기관을 통해 모집되었다.25,26) 참여자들은 연구 참여 1일~5일 전부터 COVID-19의 감염 혹은 증상이 확인되었다. COVID-19감염으로 인한 중증 위험 우려가 없는 백신접종자 및 간/신장질환자, 투석환자, 바이러스 부하 400 copies/mL 이상인 HIV 감염자 및 HIV 예방 치료자, CYP3A4의 영향을 받는 약물 복용(예정)자, 임산부, 수유부 등은 연구에서 제외되었다. 무작위배정 방식으로 나눠진 참여자들은 배정된 군에 따라 위약 혹은 nirmatrelvir/ritonavir을 5일간 매일 12시간마다 경구 복용하였다.24)
EPIC-SR 연구의 일차 평가변수는 증상 완화에 걸린 시간이며, 중간 분석에서 기준 한 증상 완화 기간은 4일이다. COVID-19 감염으로 인한 병원 진료/입원/사망, 약물 부작용 발생률, 바이러스 부하 변화는 이차 평가변수에 해당한다.25,26) 화이자는 2021년 12월 연구 참여자(1,150명)의 45%를 포함하는 중간 분석 결과를 발표했으며 nirmatrelvir/ritonavir가 위약에 비해 초기 4일간 증상 완화에 이점을 나타내지 않아 일차 평가변수를 충족하지 못했다고 밝혔다. Nirmatrelvir/ritonavir 투여군의 입원율은 70% 감소했으며, 치료 집단의 사망은 발생하지 않았다. 또한 nirmatrelvir/ritonavir 투여군에서 위약군에 비해 바이러스 부하가 10배 감소해 EPIC-HR 연구와 유사한 결과를 나타냈다. 약물 이상 반응은 두 집단에서 비슷하게 발생하였고(nirmatrelvir/ritonavir 22%, 위약 21%) 심각한 이상 반응(nirmatrelvir/ritonavir 1.4%, 위약 1.9%) 및 이상반응으로 인한 약물 중단 (nirmatrelvir/ritonavir 2.1%, 위약 1.2%) 비율 역시 두 집단에서 비슷하게 발생하였다. EPIC-SR 연구는 2022년 11월 말에 완료될 예정이다.24)
EPIC-PEP (A study of a potential oral treatment to prevent COVID-19 in adults who are exposed to household member(s) with a confirmed symptomatic COVID-19 infection)27)
화이자에서 진행한 EPIC-PEP 연구는 COVID-19에 감염되어 증상이 있는 환자에게 노출된 가족구성원을 대상으로, nirmatrelvir/ritonavir의 예방 효과를 평가하였다.27) 참가자는 96시간 이내에 COVID-19에 감염된 가족구성원에게 노출된 18세 이상 성인으로, 무증상이며 신속 항원검사에서 음성판정을 받은 사람을 대상으로 하였다. 6개월 이내에 COVID-19에 감염된 적이 있거나 고열 등의 증상이 있거나 다른 기저질환이 있는 집단은 연구에서 제외하였으며, 최근 발표된 연구 결과에는 총 2,957명의 성인 데이터가 포함되었다.28) 참가자는 1:1:1의 비율로 세 그룹에 할당하여 임상 3상, 이중 맹검, 평행그룹, 무작위 대조 시험으로 실시하였고 첫 번째 그룹은 nirmatrelvir/ritonavir를 12시간 간격으로 5일 동안 투여 후 이후 6~10일간 위약 투여, 두번째 그룹은 nirmatrelvir/ritonavir를 12시간 간격으로 10일간 투여, 그리고 세번째 그룹은 위약을 12시간 간격으로 10일간 투여하였다. 1차 평가변수는 시험 시작일부터 14일동안 참가자의 증상을 파악하였으며, RT-PCR이나 신속 항원 검사에서 양성판정을 받은 참가자의 비율로 예방 효과를 평가하였다. 2차 평가변수로는 시험 시작일부터 38일동안 부작용을 경험한 참가자의 비율을 통해 안전성을 평가하였다.
이 연구에서는 위약과 비교하여 감염예방을 위해 5일 및 10일동안 nirmatrelvir/ritonavir을 투여받은 성인에서 각각 32% 및 37%의 위험 감소를 관찰하였지만, 이 결과는 통계적으로 유의하지 않아 가정 접촉을 통해 바이러스에 노출된 성인에서 COVID-19 감염 위험을 줄이는 1차 평가변수를 충족하지 못하였다. 본 연구에서의 안전성 데이터는 EPIC-HR 및 EPIC-SR과 유사하였으며, 이 안전성 데이터는 nirmatrelvir/ritonavir을 5일 또는 10일 동안 사용하였을 때 일반적으로 일관되게 유지되었다.28)
|
Table 2 Summary of the EPIC-HR clinical study2) |
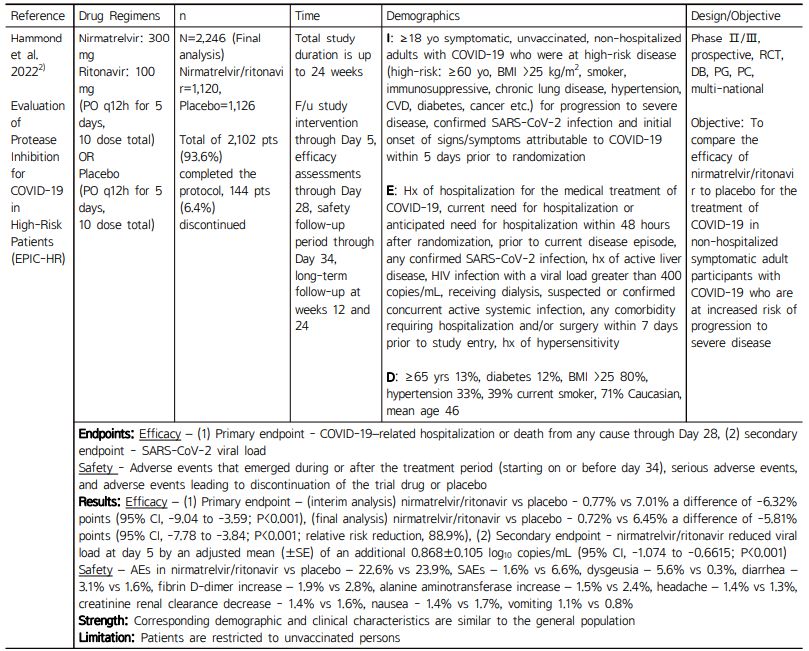
AEs = adverse events, BMI = body mass index, CVD = cardiovascular disease, CYP = cytochrome, DB = double blind, E = exclusion, Hx = history, I = inclusion, PC = placebo control, PG = parallel group, RCT = randomized controlled trial, SAEs = serious adverse events |
Nirmatrelvir/ritonavir에 대한 임상 데이터는 제한적이나 nirmatrelvir/ritonavir의 EPIC-HR 2/3상 임상시험을 통해서 nirmatrelvir/ritonavir의 안전성에 대해서 확인할 수 있었다. 시험 도중 발생한 약물 이상반응 발생률은 시험군이 22.6%, 위약군이 23.9%로 유사하였고 이 중 시험 약물 또는 위약과 관련된 것으로 간주되는 약물 이상반응의 발생률은 시험군이 7.8%, 위약군이 3.8%로 시험군이 높았으나 이러한 약물 이상반응(인과성에 관계없이 모든 등급의 이상반응 포함)은 미각이상(시험군 5.6%, 위약군 0.3%), 설사(3.1%, 1.6%), 피브린 D-이량체 증가(1.9%, 2.8%), 알라닌 아미노전이효소 증가(1.5%, 2.4%), 두통(1.4%, 1.3%), 크레아티닌 신장 청소율 감소(1.4%, 1.6%), 메스꺼움(1.4%, 1.7%) 및 구토(1.1%, 0.8%) 등으로 대부분 경미한 이상반응에 해당했다.2)
그 외에 nirmatrelvir/ritonavir의 주의사항은 다음과 같다. 첫 번째로 약물상호작용으로 인한 부작용을 주의해야 하는데 이는 ritonavir가 CYP3A 억제제로 작용하기 때문이다. 따라서, nirmatrelvir/ritonavir는 CYP3A에 의해 대사되는 약물의 혈장 농도를 증가시킬 수 있고 CYP3A를 억제하거나 유도하는 약물은 nirmatrelvir/ritonavir의 농도를 각각 증가시키거나 감소시킬 수 있다(관련 약물들은 약물 상호작용 섹션 참조). 두 번째로 두드러기, 혈관부종을 포함한 nirmatrelvir/ritonavir의 주성분이나 첨가제에 대한 과민반응을 주의해야 한다. 호흡곤란, 가벼운 피부 발진, 가려움증, 아나필락시스, 독성표피괴사(toxic epidermal necrolysis, TEN) 및 스티븐스-존슨 증후군 등과 같은 임상적으로 유의한 과민반응 또는 그 징후와 증상이 발생하면 즉시 nirmatrelvir/ritonavir를 중단하고 적절한 약물 및 지원 치료를 시작해야 한다. 세 번째로 간독성에 주의해야 한다. Ritonavir를 복용한 환자에서 간 아미노전이효소 수치 상승, 간염, 황달이 발생하였기에 nirmatrelvir/ritonavir를 환자에게 투여할 때 간 질환, 간효소 이상 또는 간염에 주의해야한다.8)
임부 또는 수유 중인 산모를 대상으로 투여된 적은 없지만, nirmatrelvir/ritonavir 구성성분 중 하나인 ritonavir의 경우 임부에 대한 치료 경험이 충분하고 기형을 증가시키지 않는다. Nirmatrelvir의 경우 임신부 경험은 아직 없지만 쥐 동물 시험에서 인체 용량의 8배를 투여해도 기형 및 유산, 사산 증가가 발생하지 않았다. 토끼도 인간 용량의 3배에서 기형, 유산, 사산 증가 양상은 보이지 않았다.2,29)
수유부에 대한 nirmatrelvir/ritonavir의 임상경험은 아직 없다. Nirmatrelvir가 사람 또는 동물 모유에 존재하는지, 수유 받는 유아 또는 모유 생성에 미치는 영향에 대한 자료는 보고된 바가 없다.8) Ritonavir는 영아에서의 위험성을 배제할 수 없다.30) 우리나라 식약처에서는 임부는 유익성이 위해성을 상회하는 경우 투여, 수유부는 투여 중 수유 중단을 권고하고 있다.22)
Ritonavir는 CYP3A4의 억제를 통해 nirmatrelvir의 대사를 방해하여 혈중 농도를 높이는 역할을 하며, nirmatrelvir과 ritonavir은 CYP3A의 기질이다. Ritonavir는 CYP3A4 및 수송체 p-glycoprotein를 억제하여 임상적으로 유의한 약물-약물 상호작용을 발생시킬 수 있으며 이는 nirmatrelvir/ritonavir 사용 시 주요한 제한요인이 된다. 약물 사용 시 체내 대사에서 CYP3A4의 기여도가 nirmatrelvir/ritonavir와 병용 약물 간의 상호작용 수준을 결정하며, 다중 대사 경로를 가진 약물에서는 상호작용 정도가 완화되는 경향이 있다.31)
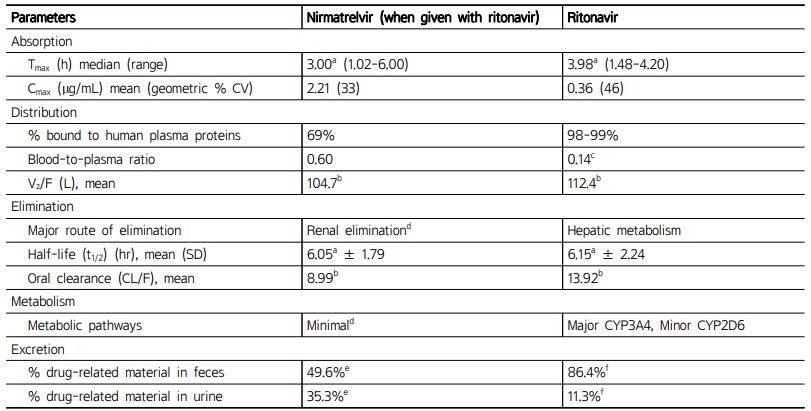
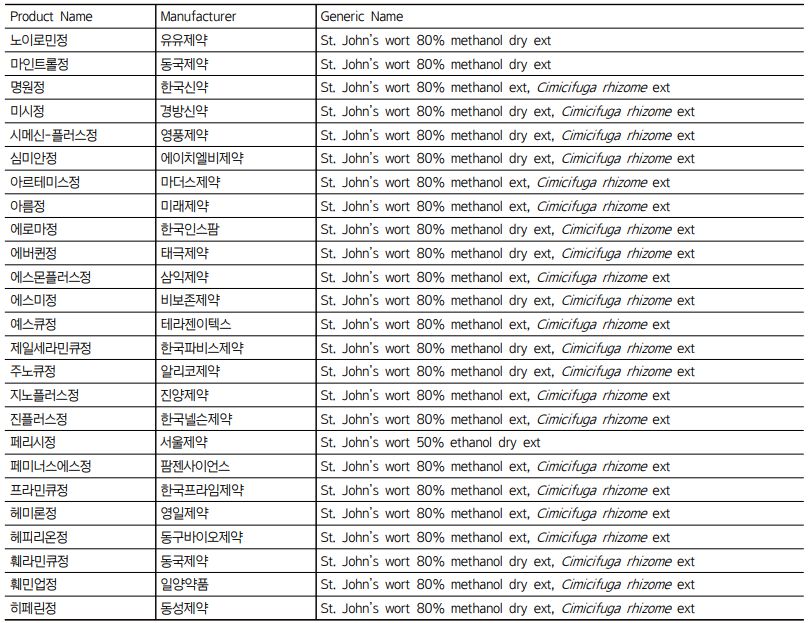
국내 허가 의약품 중 nirmatrelvir/ritonavir와의 병용 금지 약물 성분은 alfuzosin을 포함한 총 23종이다(Table 3).8,32) St. John’s wort, carbamazepine, phenobarbital, phenytoin, rifampin, apalutamide 6종은 현재 복용 중일 경우 해당 약물 복용을 중지해도 nirmatrelvir/ritonavir를 투여할 수 없다.5)
병용 금지 의약품 중 St. John’s Wort 성분이 함유된 일반 의약품은 불안, 우울증 등 갱년기 증상 완화에 주로 사용된다. 따라서 nirmatrelvir/ritonavir 처방이 된 경우 약물검토 과정에서 해당 일반 의약품의 복용 여부가 반드시 확인되어야 한다(Table 4).5) 상대적으로 nirmatrelvir/ritonavir 사용 시 약물 상호작용의 영향이 심각하지 않은 약물의 경우 병용 금기 대상은 아니지만 모니터링 혹은 용량 조절이 요구될 수 있는 약물들도 다수 있다. Digoxin, tacrolimus, 전신 스테로이드 등의 약물이 이에 해당하며 nirmatrelvir/ ritonavir과 병용 시 혈중 농도의 증가가 발생할 수 있어 적절한 모니터링이 필요하다.8,31,32)
Nirmatrelvir/ritonavir와 관련된 약물 상호작용은 약물 특성과 환자 상황에 따라 네가지 방법으로 관리할 수 있다.31) 처방의는 환자의 특성과 동반 질환을 바탕으로 득과 실을 비교하여 다음 중 적합한 방법을 택할 수 있다: 1) 복용중인 약물 선제적으로 중단; 2) 복용중인 약물의 모니터링 또는 용량 조정; 3) 환자 상담을 통해 증상의 정도에 따라 복용중인 약물 중단; 4) COVID-19의 대체 치료법 선택.
1) 가능한 경우 병용 금기 약물을 일시적으로 중단한다. 문제가 예상되는 약물을 일시적으로 중단하면 대부분의 약물 상호작용을 관리할 수 있다.
2) 복용중인 약물의 모니터링 또는 단기적인 용량 조정은 보다 세밀한 관리를 요하기 때문에 시행이 어려운 방법이다. 예를 들어 Ritonavir는 p-glycoprotein을 억제해 digoxin 농도를 크게 증가시킨다. 이 때 환자의 digoxin 투여량 및 투여기간, 신기능 상태 등에 따라 상호작용 정도가 다르게 나타날 수 있기 때문에 모니터링을 통해 개별화된 용량 조정을 시행해야 한다.31) Amlodipine과 같은 약물은 ritonavir가 CYP3A4을 억제해 혈중농도에 영향을 받지만 투여량을 조절해 약물 상호작용을 관리할 수 있다.31)
3) 환자 상담을 통해 질환 및 증상에 따라 복용 중인 약물을 중단한다.
4) 약물 치료 중단 시 큰 위험이 초래되는 경우 혹은 복용 약물의 반감기가 길어 약물을 중단해도 약물-약물 상호작용이 우려되는 경우 대체 COVID-19 치료법을 고려한다. 관상 동맥 스텐트 삽입술 후 6주 이내 clopidogrel을 중단하는 것은 매우 위험하므로, 환자에게 정맥 투여가 가능한 경우 약물 상호작용 위험이 낮은 remdesivir가 대체 치료 약물이 될 수 있다.35) 또한 지속시간이 길어 치료 중단 이후에도 약물 상호작용이 예상되는 carbamazepine은 지속적인 모니터링 하에 remdesivir 혹은 tocilizumab과 같은 대체 치료제를 사용할 수 있다.36)
Nirmatrelvir/ritonavir 처방 시 최신 정보원을 사용해 병용 약물과의 상호작용을 확인하도록 한다. 보다 안전한 처방을 위해 전문의약품과 일반의약품 및 생약을 포함하여 모든 약물과의 약물상호작용에 대해 고려해야 한다. Nirmatrelvir/ritonavir의 약물상호작용에 대한 정보는 National Institutes of Health COVID-19 Treatment Guidelines (https://www.covid19treat mentguidelines.nih.gov/) 또는 Liverpool DDI Checker (www. covid19-druginteractions.org)에서 확인할 수 있다.31)
|
Table 4 Over-the-counter (OTC) drugs in South Korea containing St. John’s wort33,34) |
Nirmatrelvir/ritonavir는 포함된 두 종류의 정제를 모두 복용해야 한다. 이 때 일반적인 투여 용량은 nirmatrelvir 150mg 2정과 ritonavir 100mg 1정을 1일 2회 총 5일간 복용하는 것이다(Fig. 3).23) Nirmatrelvir/ritonavir는 COVID-19 확진 후 5일 이내에 가능한 빨리 복용하도록 한다.23)
Nirmatrelvir/ritonavir을 복용하는 환자는 증상이 완화되더라도 정해진 용법/용량을 임의로 변경하지 않고 정해진 5일분을 모두 복용해야 한다. 또한 해당 약물 특성상 병용금기 약물이 많기 때문에 전문가의 진단, 처방 없이 임의로 투약하는 것이 매우 위험하다.37) 병용 금지 약물 중 St. John’s wort는 갱년기 증상 완화를 위한 일반의약품에 주로 함유된 성분으로 약국에서는 St. John’s wort 함유 일반의약품에 대한 주의가 필요하다(Table 4).5) 또한 nirmatrelvir/ritonavir와의 병용 금기 약물에는 alfuzosin을 포함한 23종이 있어 세심한 주의와 확인이 필요하다(Table 3).
Nirmatrelvir/ritonavir의 복용을 잊은 경우, 복용 예정 시간으로부터 8시간이 경과되지 않았다면 즉시 예정된 용량을 복용한다. 만약 복용 예정 시간으로부터 8시간이 경과되었다면 그 다음번의 복용 예정 시간에 정해진 용량을 복용한다. 이때, 잊은 복용량을 보충하기 위해 예정된 복용량을 두 배로 늘려서 복용하지 않아야 한다. Nirmatrelvir/ritonavir는 식사와 관계없이 복용할 수 있고 통째로 삼켜야 하며 씹거나 부수지 않아야 한다.8,23)
임상시험 중 보고된 이상반응에 따르면 이 약물을 복용하는 경우 미각이상, 설사 및 근육통이 부작용으로 나타날 수 있다.23)
|
Fig. 3 Administration instructions for Paxlovid |
Nirmatrelvir/ritonavir는 국내에서 처음 긴급사용 승인을 받은 경구용 COVID-19 치료제로, COVID-19가 확진된 환자 중 중증으로 진행될 위험이 높은 경증 및 중등증 성인 및 12세 이상 소아 환자에서 증상발현 5일 이내에 총 5일 동안 투약하는 약물이다. 임상연구 결과 이 약물은 위약에 비교하여 COVID-19 관련 입원 및 사망을 감소시키고, 부작용으로는 미각이상, 설사 및 근육통 등이 주로 발생하는 것으로 나타났지만, 아직까지는 다양한 환자 군을 대상으로 한 장기간의 연구는 부족한 실정이다. 또한 ritonavir에 의한 CYP3A4 억제 등 다양한 약물 상호작용 가능성이 있으며, 중증 간장애 및 신장애 환자에서는 복용할 수 없어 주의가 필요하기에 nirmatrelvir/ritonavir을 복용하는 환자들에 대한 약사들의 세심한 모니터링과 복약지도가 요구된다.
- 1. Muralidar S, Ambi SV, Sekaran S, Krishnan UM. The emergence of COVID-19 as a global pandemic: understanding the epidemiology, immune response and potential therapeutic targets of SARS-CoV-2. Biochimie 2020;179:85-100.
-

- 2. Hammond J, Leister-Tebbe H, Gardner A, et al. Oral nirmatrelvir for high-risk, nonhospitalized adults with COVID-19. N Engl J Med 2022;386(15):1397-408.
-

- 3. Kim S. COVID-19 drug development. J Microbiol Biotechnol 2022;32(1):1-5.
-

- 4. Remdesivir. [Internet database] Kimsonline. Kims: 2022.
- 5. Korea Disease Control and Prevention Agency. Guidelines for the use of COVID-19 therapy, 4-1. https://www.kdca.go. kr/upload_comm/syview/doc.html?fn=164308601159800.pdf&rs=/upload_comm/docu/0019/. Published January 24, 2022. Accessed April 26, 2022.
- 6. Ninistry of Food and Drug Safety. Ministry of Food and Drug Safety approves emergency use of Lagevrio oral capsule for COVID-19 treatment. https://www.mfds.go.kr/brd/m_99/view.do?seq=46243&srchFr=&srchTo=&srchWord=&srchTp=&itm_seq_1=0&itm_seq_2=0&multi_itm_seq=0&company_cd=&company_nm=&page=1. Published March 23, 2022. Accessed April 26, 2022.
- 7. Molnupiravir. [Internet database] Kimsonline. Kims: 2022.
- 8. U.S. Food and Drug Administration. Fact sheet for healthcare providers: emergency use authorization for PaxlovidTM. https://www.fda.gov/media/155050/download. Revised April 14, 2022. Accessed January 27, 2022.
- 9. Ministry of Food and Drug Safety. Emergency use approval of oral COVID-19 treatment 'Paxlovid'. http://www.nifds. go.kr/brd/m_21/view.do?seq=13116. Published December 28, 2021. Accessed April 26, 2022.
- 10. Jang WD, Jeon S, Kim S, Lee SY. Drugs repurposed for COVID-19 by virtual screening of 6,218 drugs and cell-based assay. Proc Natl Acad Sci USA 2021;118(30):e2024302118.
-

- 11. de Wit E, van Doremalen N, Falzarano D, Munster VJ. SARS and MERS: recent insights into emerging coronaviruses. Nat Rev Microbiol 2016;13(8):523-34.
-

- 12. Menéndez JC. Approaches to the potential therapy of COVID-19: a general overview from the medicinal chemistry perspective. Molecules 2022;27(3):658.
-

- 13. Owen DR, Allerton CMN, Anderson AS, et al. An oral SARS-CoV-2 Mpro inhibitor clinical candidate for the treatment of COVID-19. Science 2021;374(6575):1586-93.
-

- 14. Vandyck K, Deval J. Considerations for the discovery and development of 3-chymotrypsin-like cysteine protease inhibitors targeting SARS-CoV-2 infection. Curr Opin Virol 2021;49:36-40.
-

- 15. Ionescu MI. An Overview of the Crystallized Structures of the SARS-CoV-2. Protein J 2020;39(6):600-618.
-

- 16. Muramatsu T, Takemoto C, Kim YT, et al. SARS-CoV 3CL protease cleaves its C-terminal autoprocessing site by novel subsite cooperativity. Proc Natl Acad Sci USA 2016;113(46):12997- 3002.
-

- 17. Vangeel L, Chiu W, De Jonghe S, et al. Remdesivir, Molnupiravir and Nirmatrelvir remain active against SARS-CoV-2 Omicron and other variants of concern. Antiviral Res 2022;198:105252.
-

- 18. Xiong M, Su H, Zhao W, et al. What coronavirus 3C-like protease tells us: From structure, substrate selectivity, to inhibitor design. Med Res Rev 2021;41(4):1965-98.
-

- 19. Croxtall JD, Perry CM. Lopinavir/Ritonavir: a review of its use in the management of HIV-1 infection. Drugs 2010;70(14): 1885-915.
-

- 20. Sevrioukova IF, Poulos TL. Structure and mechanism of the complex between cytochrome P4503A4 and ritonavir. Proc Natl Acad Sci USA 2010;107(43):18422-7.
-

- 21. Therapeutic Goods Administration. Australian Product Information-Paxlovid (nirmatrelvir/ritonavir tablets). https://www .tga.gov.au/sites/default/files/paxlovid-pi.pdf. Published January 20, 2022. Accessed January 25, 2022.
- 22. Ministry of Food and Drug Safety. Emergency use approval of oral COVID-19 treatment 'Paxlovid'. http://www.nifds. go.kr/brd/m_21/view.do?seq=13116. Published December 28, 2021. Accessed April 26, 2022.
- 23. Nirmatrelvir/ritonavir. [Internet database] Kimsonline. Kims: 2022.
- 24. U.S. National Library of Medicine. Evaluation of protease inhibition for COVID-19 in standard-risk patients (EPIC-SR) (NCT05011513). https://clinicaltrials.gov/ct2/show/NCT0501 1513?term=EPIC-SR&draw=1&rank=1. Published April 18, 2021. Accessed March 22, 2022.
- 25. U.S. National Library of Medicine. History of changes for study: NCT05011513. https://www.clinicaltrials.gov/ct2/history/NCT 05011513?V_5=View#StudyPageTop. Accessed March 9, 2022.
- 26. Pfizer. Pfizer announces additional phase 2/3 study results confirming robust efficacy of novel COVID-19 oral antiviral treatment candidate in reducing risk of hospitalization or death. https://www.pfizer.com/news/press-release/press-release-detail/pfizer-announces-additional-phase-23-study-results. PUblished December 14, 2021. Accessed March 22, 2022.
- 27. U.S. National Library of Medicine. A study of a potential oral treatment to prevent COVID-19 in adults who are exposed to household member(s) with a confirmed symptomatic COVID-19 infection (NCT05047601). https://clinicaltrials.gov/ct2/show/ NCT05047601?term=NCT05047601&draw=2&rank=1. Updated March 3, 2022. Accessed March 22, 2022.
- 28. Pfizer. Pfizer shares top-line results from phase 2/3 EPIC-PEP study of PaxlovidTM for post-exposure prophylactic use. https://www.pfizer.com/news/press-release/press-release-detail/pfizer-shares-top-line-results-phase-23-epic-pep-study. Published April 29, 2022. Accessed May 18, 2022.
- 29. Catlin NR, Bowman CJ, Campion SN, et al. Reproductive and developmental safety of nirmatrelvir (PF-07321332), an oral SARS-CoV-2 Mpro inhibitor in animal models. Reprod Toxicol 2022;108:56-61.
-

- 30. Ritonavir. [Internet database] Kimsonline. Kims: 2022.
- 31. Marzolini C, Kuritzkes DR, Marra F, et al. Prescribing Nirmatrelvir-Ritonavir: How to Recognize and Manage Drug-Drug Interactions. Ann Intern Med 2022;175(5):744-6.
-

- 32. Ministry of Food and Drug Safety. Paxlovid. https://nedrug. mfds.go.kr/emergencyUse/202190146.html. Accessed March 24, 2022.
- 33. St. John's wort. [Internet database] Korea Pharmaceutical Information Center; 2022.
- 34. St. John's wort. [Internet database] Kimsonline. Kims: 2022.
- 35. Ghasemiyeh P, Borhani-Haghighi A, Karimzadeh I, et al. Major Neurologic Adverse Drug Reactions, Potential Drug-Drug Interactions and Pharmacokinetic Aspects of Drugs Used in COVID-19 Patients with Stroke: A Narrative Review. Ther Clin Risk Manag 2020;16:595-605.
-

- 36. Ostuzzi G, Papola D, Gastaldon C, et al. Safety of psychotropic medications in people with COVID-19: evidence review and practical recommendations. BMC Med 2020;18(1):215.
-

- 37. Korea Disease Control and Prevention Agency. Education on the use of oral COVID-19 therapy. http://www.kagh.co. kr/data/board/Covid19/(배포)_코로나19_경구치료제_사용안내_및_교육_자료_최종(0120).pdf. Accessed April 26, 2022.
 This Article
This Article
-
2022;8(1):28-39
Published on May 31, 2022
- Received on May 19, 2022
- Accepted on May 19, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Yun Jeong Lee
-
College of Pharmacy, Dankook University 119, Dandae-ro, Dongnam-gu, Cheonan-si, Chungnam, 31116, Republic of Korea
Tel: +82-41-550-1445, Fax: +82-41-559-7899 - E-mail: yunlee@dankook.ac.kr