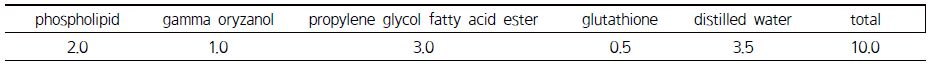원보
원보 - Oral Absorption of Reduced Glutathione Entrapped into GINSPO Nanaparticle
Karthikeyan Selvaraj1 and Bong-Kyu Yoo1,2*
1College of Pharmacy, Gacheon University, 191 Hambakmoero, Yeonsu-gu, Incheon, 21936, Republic of Korea
2ABS Bio, 310 Sicox Tower, 484 Dunchon-daero Jungwon-gu, Seongnam, Gyunggi-do, 13229, Republic of Korea- 환원형 글루타치온이 봉입된 진스포 나노입자의 경구흡수
카르티케얀 셀바라즈1, 유봉규1,2*
1가천대학교 약학대학, 2앱스바이오
This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Objective: Objective of this study was to evaluate whether the reduced glutathione (GSH) entrapped into Ginspo nanoparticle (a new solid lipid nanocarrier) was absorbed by oral route. Methods: Ginspo nanoparticle was prepared by hot-melt method. Physicochemical characteristics of the Ginspo nanoparticle were measured, and its absorption by oral route was also observed with Sprague-Dawley rats and a healthy human. Results: GSH was successfully entrapped into the Ginspo nanoparticles by hot melt method. The particle size of the Ginspo nanoparticles was 83.68±1.16 nm, and the surface charge was –20.6±3.27 mV. Considering that the glutathione is a hydrophilic material, the entrapment efficiency was expected to be very low. Interestingly, however, it was 77.2±2.88% which was extraordinarily high. When the GSH- enrapped Ginspo nanoparticles were administered at a dose of 1 mg/Kg to a healthy volunteer, baseline GSH level before administration was 74.81 ppm, and the level increased to 81.94 ppm at 15 min after administration. The GSH level gradually decreased to baseline level over an hour. Conclusion: Ginspo nanoparticle appears to be a useful option for the development of GSH formulations taken by oral route without resorting to injection formulas.
Keywords: Glutathione, Entrapment efficiency, Ginspo lipid nanoparticle, Oral absorption
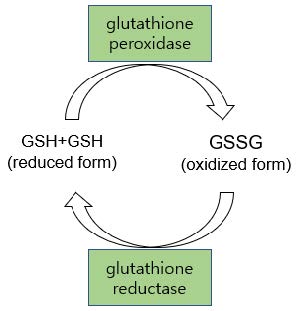
글루타치온은 동식물계 모든 조직과 세포의 전자전달계(electron transport chain) 산화환원반응에서 필수적인 물질로써 글리신, 시스테인, 글루탐산 등 세 개의 아미노산으로 구성되는 tripeptide이다.1-3) 이 tripeptide는 환원형(GSH)과 산화형(GSSG)으로 존재하는데 두 형태의 상대적 비율은 세포의 건강상태(산화환원상태, redox status)를 반영하는 지표로 사용된다.4-5) GSH는 glutathione peroxidase에 의해 두 분자가 만나 시스테인의 –SH기 두 개가 결합하여 수소(H2)가 빠져나가고 disulfide 결합으로 이어져 dimer 형태가 되는데 이것이 GSSG이다(Fig. 1). 이 반응은 세포 내에서 일어나는 수많은 전자전달계에서 중요한 역할을 한다. 만일 환원형 글루타치온이 부족하게 되면 세포에 있는 활성산소종 (reactive oxygen species, ROS)을 환원시켜 주지 못하기 때문에 세포가 손상을 받게 된다. 건강한 세포에서는 환원상태인 GSH와 산화상태인 GSSG의 비율(GSH/GSSG ratio)은 50-100 정도에 이를 정도로 환원형 글루타치온이 압도적으로 많다. 그러나 나이가 들면서 그 비율이 점점 줄어드는데 이로 인해 ROS가 체내에 축적되어 성인병을 비롯하여 노화현상이 발생하는 것으로 알려졌다.6-9)
따라서 GSH를 보충하여 노화를 지연시키기 위한 식품, 의약품 및 화장품 개발이 시도되고 있다. GSH를 정맥주사로 투여할 경우에는 이 약물이 곧바로 혈액 속으로 들어가기 때문에 생체이용률에 문제가 없다. 그러나, 경구로 복용할 경우에는 문제가 된다. GSH는 단지 세 개의 아미노산으로 구성된 short peptide이어서 소화효소와 점막세포 안에 있는 효소들에 의해 쉽게 분해되기 때문이다.
따라서 GSH를 경구로 복용시 과연 얼마나 흡수되어 혈액 속으로 이행될까에 대한 의문이 오래전부터 제기되어 왔다.10-11) 이에 대한 연구는 여러 연구자들에 의해 실시되었으며, 1992년 스위스 베른 대학의 Lauterburg 교수팀이 실시한 임상시험 결과에서 GSH는 경구로 복용 시 GSH 혈중농도가 임상적으로 유효한 정도까지 올라가지 않는다는 것이 밝혀졌으며 지금까지 이 지견이 일반적으로 통용되고 있다.12-13)
이후 일본 Kyowa Hakko는 GSH를 리포솜에 봉입하여 Setria라는 상품명으로 food supplement (우리나라의 건강식품에 해당)를 출시하였다. Kyowa Hakko는 이 건강식품이 경구 투여시 흡수되어 임상적 효과를 나타내는지 여부를 미국 Penn State Cancer Institute에서 6개월에 걸쳐 54명의 건강인 지원자를 대상으로 임상시험을 실시하였다. 이 임상시험의 결과는 2015년 유럽영양학회지에 게재되었으며 GSH가 리포솜에 봉입되면 경구투여로도 흡수될 뿐만 아니라 면역기능증진 등 임상적으로 유용한 기능을 발휘하는 것으로 밝혀졌다.14)
본 연구에서는 인지질 기반으로 제조된 solid lipid nanocarrier의 일종인 Ginspo 나노입자에 GSH를 봉입하여 쥐에게 경구로 투여하고 시간별로 혈중농도를 측정하여 GSH가 소화관에서 흡수되는지 여부를 실험하였다. Ginspo의 물리화학적 특성과 봉입된 GSH의 안정성도 함께 관찰하였다. 연구자들은 나이 어린 쥐를 이용하여 소화관흡수실험을 실시한 결과, Ginspo 나노입자가 소화관에서 흡수되어 혈중 GSH 농도를 유의하게 상승시키는지 여부를 관찰할 수 없었다. 이에 그 원인을 고찰한 다음 60세 이상인 성인 인간 지원자에게 경구투여하는 시험을 실시하였으며, Ginspo 나노입자가 소화관에서 유의하게 흡수되는 것을 확인하였기에 그 결과를 발표하고자 한다.
|
Fig. 1 Reduced and oxidized forms of glutathione in electron transport chain |
재료 및 시약
GSH는 일본 TCI (Tokyo, Japan)에서 순도 97% 이상 등급인 환원형으로 구입하여 사용하였다. 인지질은 독일 Lipoid (Steinhausen, Germany)에서 포스파티딜콜린 함량이 95%이상인 Phospholipon 90G를 사용하였고, 감마오리자놀은 TCI 제품을 구입하여 사용하였다. 그밖에 다른 시약은 별도의 정제과정 없이 사용하였다.
진스포 나노입자의 제조
GSH가 첨가된 진스포 나노입자는 hot melt 방법으로 제조하였다. 구체적으로, 레시틴과 감마오리자놀을 propylene glycol fatty acid ester에 넣고 95°C로 가온하여 녹인 다음 자석교반기를 이용하여 균질하게 혼합되도록 하였다. GSH는 별도의 용기에서 자석교반기를 이용하여 상온에서 증류수에 녹인 다음 레시틴 등 유상용액과 함께 homogenizer를 이용하여 24,000rpm에서 5분간 균질화하여 나노입자 분산액이 되도록 하였다. 균질화가 완료되면 –40°C로 냉동시킨 다음 72시간 동안 동결건조하고 다음 실험에 사용하기 전까지 –20°C에 보관하였다. 진스포 나노입자의 조성은 Table 1에 나타내었다.
진스포 나노입자 분산액의 물리화학적 특성
GSH 함유 진스포 나노입자 동결건조물 일정량에 증류수를 가하고 초음파로 분쇄한 다음 입자크기 및 다분산 지수(PDI)를 측정하였다. 입자 크기 및 다분산 지수(PDI)는 Zetasizer Nano S90 (Malvern, UK)을 사용하여 90°의 고정 각도에서 동적광산란을 사용하여 분석하였다. 진스포 나노입자 분산액의 입자전하(제타 전위)는 나노입자 분산액을 인산완충액(pH 7.0)으로 고체 함량이 0.5% w/v가 되도록 희석한 다음 25°C에서 전기영동광산란법(Photal ELSZ- 1000)을 사용하여 측정하였다.
진스포 나노입자 분산액 중 GSH가 얼마나 나노입자에 봉입되어 있는지를 측정하는 봉입효율(Entrapment efficiecy, EE)은 ultrafiltration 방법으로 아래와 같이 실시하였다. 진스포 나노입자 분산액 (1ml)을 Amicon Ultra-4 Filter Unit (MWCO: 10,000 g/mol)에 넣고 4°C에서 30분 동안 10,000 rpm에서 원심분리함으로써 봉입되지 않은 GSH 분자가 filter unit를 통과하도록 한 다음, 통과된 분획 중의 GSH를 HPLC로 측정하였다. 진스포 나노입자 분산액의 총 GSH온 양은 별도의 실험을 통해서 측정하였다. 구체적으로, 진스포 나노입자 분산액을 메탄올로 20배 희석하여 나노입자가 파괴되도록 한 후 0.2 ㎛ syring filter로 여과한 여과액에 대하여 HPLC를 사용하여 GSH의 함량을 측정했다. EE는 다음의 식을 사용하여 계산하였다. 여기서 Dtotal 및 Dunentrapped는 각각 진스포 나노입자 분산액에서 총 GSH 및 봉입되지 않은 GSH의 양이다.

GSH 봉입 진스포 나노입자 분산액의 경구투여
체중이 250±20g인 수컷 Sprague-Dawley 쥐를 OrientBio (성남시, 대한민국)에서 구입하여 실험 전 1주일 동안 순화적응을 시킨 다음 실험을 실시하였다. 모든 동물 관리 및 절차는 가천대학교 약학대학 동물관리 지침에 따라 수행하였다(승인번호: GIACUC-R2019007). 10마리의 쥐를 실험군과 대조군에 각각 5마리씩 무작위로 할당하고 실험 전 12시간 동안 금식하고 수분섭취는 자유롭게 하였다. 시험군과 대조군의 쥐에게는 각각 GSH 봉입 진스포 나노입자 분산액 또는 순수한 GSH 수용액을 50mg/Kg 용량으로 경구투여했다. 이때 진스포 나노입자 분산액 및 순수한 GSH 수용액은 1% Tween20 수용액을 사용하여 GSH 농도가 20mg/ml이 되도록 조제하였다. 채혈은 30분, 1.5시간, 3.5시간 시점에 쇄골하 정맥에서 헤파린 처리된 Eppendorf 튜브에 취하였다. 채혈된 혈액은 즉시 12,000 rpm에서 2분 동안 원심분리하고 혈장을 분리하여 –20°C에서 보관했다. 혈장 중 GSH의 양은 아래에 기술된 HPLC 방법으로 분석하였다.
HPLC
GSH 분석은 LC 20AD 펌프와 SPD 20A UV-VIS 검출기가 장착된 HPLC 시스템(Shimadzu, Japan)으로 실시하였다. 컬럼은 Inertsil (4.6×250 mm)을 사용하였고 이동상은 아세토니트릴과 0.1% phosphoric acid 수용액 (1:99 v/v), 컬럼 온도는 30°C, 주입 부피는 20μl, 유속은 1.0 ml/min으로 하였다. 검출기는 210 nm 자외선으로 하고 검출농도 범위는 200-20,000 ng/ml로 하여 연속 5일 동안 하루에 5번 반복하여 밸리데이션을 수행하였다. in-vivo 실험의 시료를 분석하는 경우에는 추가적으로 L-arginine을 내부표준물질로 사용하여 HPLC 분석을 실시하였다.
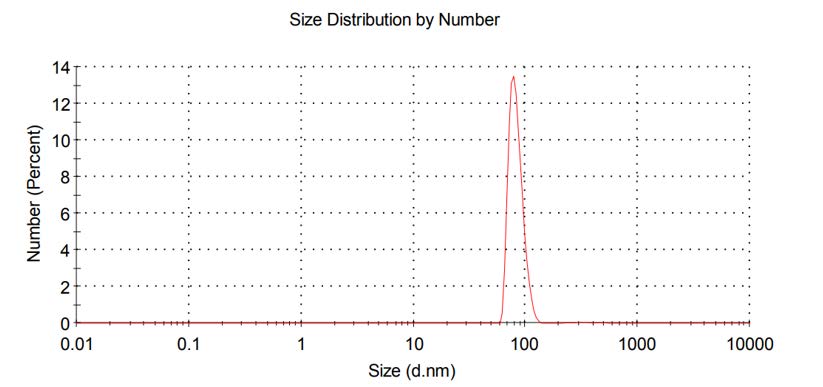
연구방법에서 기술한 방법으로 제조한 GSH 함유 진스포 나노입자는 증류수를 가하고 초음파로 분쇄 시 입자크기가 83.68±1.16으로써 100 nm 이하의 균질한 분산액이 되었다(Fig. 2). 나노입자 분산액의 균질성을 나타내는 다분산지수(polydispersity index)는 0.284±0.002로서 균질하게 분산된 것으로 평가되었다. 일반적으로 다분산지수가 0.3 이하이면 균질한 것으로 간주된다. 진스포 나노입자의 표면전하는 음전하인 것으로 나타났으며 전하의 세기는 –20.6±3.27mV로 나타났다(Table 2).
인지질은 분자구조 내에 인산기가 있어 등전점 이상의 pH에서는 proton이 이탈되어 음전하가 되는데 본 연구에서 제조한 진스포 나노입자의 경우 인지질의 등전점이 pH 7.0 이하인 것으로 여겨진다. 나노입자 분산액은 초음파 에너지를 이용하여 만들어지는 불안정한 분산상태이기 때문에 시간이 지나면서 입자들이 서로 응집하여 침전으로 가라앉는 경향이 있다. 나노입자들이 표면에 전하를 띄게 되면 정전기적 반발력으로 인해 응집이 억제되고 따라서 분산액이 장기간 동안 안정하게 유지될 수 있는데 진스포 나노입자는 이 점에서 유리한 제제인 것으로 사료된다.
진스포 나노입자에 GSH를 봉입한 결과 봉입효율은 77.2±2.88%로 매우 높게 나타났다. 일반적으로 지질 기반 나노입자는 소수성약물을 봉입하는데는 유용하지만 친수성약물을 봉입하는데는 적절하지 않은 것으로 알려졌다. 예를 들어 항암제로 널리 사용되고 있는 독소루비신 염산염의 경우 친수성이 매우 강한 약물이기 때문에 리포좀으로 제제화하고자 할 경우 봉입효율을 높이는 것이 매우 중요한 know how이다. GSH 역시 친수성이 매우 높은 약물이기 때문에 봉입효율이 매우 낮을 것으로 예상되었다. 그러나 본 연구에서 봉입효율이 70% 이상으로 나타난 것은 진스포 나노입자가 친수성약물을 봉입하는데 매우 유용하다는 것을 보여주는 결과이다.
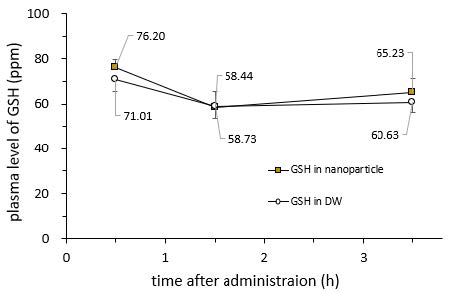
GSH 함유 진스포 나노입자를 쥐에게 50 mg/Kg 용량을 경구로 투여한 결과는 Fig. 3에 나타내었다. GSH 함유 진스포 나노입자의 경우 투여 후 30분 시점에서 76.20 ppm으로 나타나 순수한 GSH의 71.01 ppm에 비해 다소 높았지만 통계적 유의성은 없었다(p-value: 0.079). 투여 후 1.5시간 및 3.5시간 시점에서도 통계적으로 유의한 차이는 발견되지 않았다. 본 연구에서 쥐를 이용한 경구투여 흡수실험은 두 가지의 한계점 내지 오류가 있었음을 데이터 처리 시점에서 발견하였다. 첫째는 채혈시점을 설정하는데 있어서 GSH 투약 직전인 time zero를 포함하지 않은 점이다. 둘째는 실험에 사용된 쥐의 나이가 8주령으로써 아직 성장시점인 매우 어린 상태이므로 체내 GSH/GSSG ratio가 매우 높고 GSH의 혈중 baseline level 또한 매우 높아서 GSH 경구투여가 혈중 GSH 농도에 유의성이 있을 만큼의 변화를 나타내기 어렵다는 것을 예상하지 못한 점이다.
생후 주령이 8주인 쥐는 사람의 나이로 환산하면 10세 미만의 젊고 건강한 상태이므로 혈중 GSH 농도가 매우 높은 상태로 유지되어 있을 것이다. 그런 상태에서는 혈중농도가 상승하여도 그 정도가 미미하기 때문에 유의성 있는 차이가 없었던 것으로 사료된다. 쥐의 평균수명이 2.5-3.5년인 점을 반영하여 나이가 2년 이상인 쥐를 사용해서 본 실험을 실시하면 유의성 있는 결과를 얻을 수 있을 것으로 예상된다. 그러나 나이가 2년 이상인 쥐를 구입하기는 현실적으로 매우 어려운 실정이다.
따라서 어린 쥐를 이용하는 경구흡수실험의 한계점을 극복하기 위해 연구자들은 60세 이상인 건강한 인간 지원자에게 GSH 봉입 진스포 나노입자를 복용시키고 혈중농도를 측정하기로 하였다. 또한 time zero에서 채혈도 실시하여 baseline에서 변화된 측정값까지 관찰할 수 있도록 하였다.
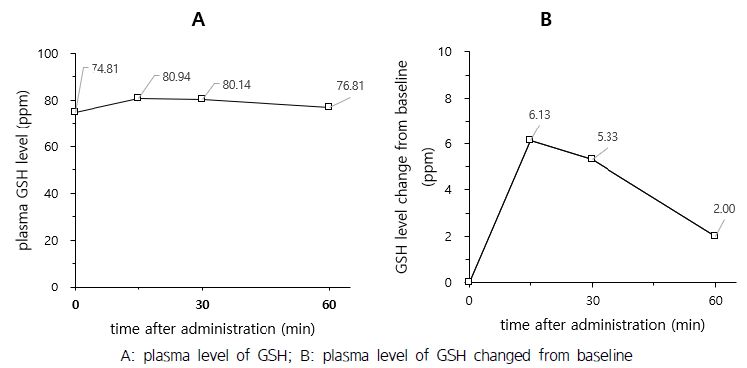
그 결과, GSH 봉입 진스포 나노입자를 1 mg/Kg 용량으로 60세 이상 건강한 지원자에게 투여한 실험에서 GSH 혈중농도 변화 패턴에 유의한 결과를 얻을 수 있었다(Fig. 4A). 투여 전 혈중 GSH baseline 값은 74.81ppm이었으며 최대 혈중농도는 투여 후 15분 시점에서 81.94ppm으로 나타났다. GSH 혈중농도는 점차로 감소하여 1시간 시점에서는 76.81ppm으로써 거의 투여 전 baseline 수준으로 복귀하는 것을 발견하였다. GSH의 baseline 값을 공제하고 변화된 값을 계산하여 나타낸 그래프는 Fig. 4B에 나타내었다. 이 그래프에서 GSH 봉입 진스포 나노입자의 경구투여 시 혈중농도 최대 증가치는 15분 시점에서 6.13ppm이었으며 30분 시점에서의 혈중농도 증가치는 5.33ppm인 것으로 나타났다.
|
Fig. 2 Size distribution of GSH-loaded Ginspo nanoparticle dispersion |
|
Fig. 3 Plasma level of GSH after oral administration of GSH into five rats |
|
Fig. 4 Plasma level of GSH after oral administration of GSH-loaded Ginspo nanoparticle into a healthy human |
|
Table 2 Characterization of GSH-loaded Ginspo nanoparticle dispersion |

EE: entrapment efficiency; PDI: polydispersity index |
진스포 나노입자는 표면전하가 음전하를 띄고 있어 안정한 분산액을 장기간 유지할 수 있으며 또한 GSH와 같이 수용성인 약물을 높은 봉입효율로 탑재하는데 매우 유용한 것으로 평가된다. 또한 진스포 나노입자는 GSH를 봉입하여 매우 낮은 용량(1mg/Kg)으로 경구투여 시에도 빠른 시간 안에 혈중으로 흡수되어 GSH의 혈중농도룰 상승시키는 것으로 나타났다. 따라서 GSH를 주사제로 투여하지 않고도 혈중으로 흡수되는 경구형 제제를 개발하는데 진스포 나노입자가 유용하게 사용될 수 있을 것으로 기대된다.
- 1. Hansen SH, Grunnet N. Taurine, glutathione and bioenergetics. Adv Exp Med Biol 2013;776:3-12.
-

- 2. Forman HJ, Zhang H, Rinna A. Glutathione: overview of its protective roles, measurement, and biosynthesis. Mol Aspects Med 2009;30:1-12.
-

- 3. Sies H. Glutathione and its role in cellular functions. Free Radic Biol Med 1999;27:916-921.
-

- 4. Pizzorno J. Glutathione. Integrative Medicine 2014;13:9-12.
- 5. Owen JB, Butterfield DA. Measurement of oxidized/reduced glutathione ratio. Methods Mol Biol 2010;648:269-277.
-

- 6. Bjorklund G, Tinkov AA, Hosnedlova B, et al. The role of glutathione redox imbalance in autism spectrum disorder: A review. Free Radic Biol Med 2020;160:149-162.
-

- 7. Sentellas S, Morales-Ibanez O, Zanuy M, et al. GSSG/GSH ratios in cryopreserved rat and human hepatocytes as a biomarker for drug induced oxidative stress. Toxicol In Vitro 2014;28:1006-1015.
-

- 8. Cao L, Waldon D, Teffera Y, et al. Ratios of biliary glutathione disulfide (GSSG) to glutathione (GSH): a potential index to screen drug-induced hepatic oxidative stress in rats and mice. Anal Bioanal Chem 2013;405:2635-2642.
-

- 9. Alzoubi KH, Al-Jamal FF, Mahasneh AF. Cerebrolysin prevents sleep deprivation induced memory impairment and oxidative stress. Physiol Behav 2020;217:112823.
-

- 10. Dilokthornsakul W, Dhippayom T, Dilokthornsakul P. The clinical effect of glutathione on skin color and other related skin conditions: A systematic review. J Cosmet Dermatol 2019;18:728-737.
-

- 11. Sharma DK, Sharma P. Augmented Glutathione Absorption from Oral Mucosa and its Effect on Skin Pigmentation: A Clinical Review. Clin Cosmet Investig Dermatol 2022;15: 1853-1862.
-

- 12. Hunjan MK, Evered DF. Absorption of glutathione from the gastro-intestinal tract. Biochim Biophys Acta 1985;815: 184-188.
-

- 13. Witschi A, Reddy S, Stofer B, et al. The systemic availability of oral glutathione. Eur J Clin Pharmacol 1992;43:667-669.
-

- 14. Richie JP Jr, Nichenametla S, Neidig W, et al. Randomized controlled trial of oral glutathione supplementation on body stores of glutathione. Eur J Nutr 2015;54:251-263.
-

 This Article
This Article
-
2022;8(2):72-76
Published on Nov 30, 2022
- Received on Nov 2, 2022
- Revised on Nov 9, 2022
- Accepted on Nov 10, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Bong-Kyu Yoo
-
191 Hambakmoero, Yeonsu-gu, Incheon, 21936, Republic of Korea
Tel: +82-31-735-2822, Fax: +82-31-735-2823 - E-mail: byoo@gachon.ac.kr