원보
원보 - The Roles of Pharmacists in Chimeric antigen Receptor T (Car-T) Cell Therapy
Sang Hoon Joo*
College of Pharmacy, Daegu Catholic University, Gyeongsan 38430, Korea
- 키메라 항원 수용체 T세포(Car-T세포) 치료요법에서 약사의 역할
주상훈*
대구가톨릭대학교 약학대학
This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Cancer immunotherapy has ushered in a new era in cancer treatment, offering hope to patients with previously incurable diseases. Chimeric antigen receptor T (CAR-T) cell therapy, a cutting-edge form of cancer immunotherapy that involves reprogramming a patient's immune cells to target and destroy cancer cells, represents both cell therapy and gene therapy, and has recently been added to the pharmacists' toolkit. The advent of CAR-T cell therapy presents both opportunities and challenges to pharmacists, whose roles have expanded in tandem with the development of biotechnology. This lecture provides an overview of the basic concepts of CAR-T cell therapy, including its development, preparation, indications, mechanism, administration, and side effects. It also examines the vital roles pharmacists play in the CAR-T cell therapy process, from patient selection to medication management and patient monitoring. The essential roles pharmacists play in the use of CAR-T cell therapy will optimize patient outcomes.
Keywords: Chimeric antigen receptor, Cell therapy, Gene therapy, Pharmacist, Cancer, Immunotherapy.
최근 주목 받고 있는 면역 항암치료(cancer immunotherapy)는 환자의 면역체계를 이용해 암세포를 공격하는 새로운 형태의 암 치료 방법이다. 면역 항암치료는 단기간에 다른 종류의 항암치료제를 대체하거나 보강하면서 더욱 더 많은 암의 치료에 도입되고 있는 실정이다. 키메라 항원 수용체(chimeric antigen receptor; CAR) T세포(CAR-T세포, ‘카르티세포’로 발음한다) 치료제는 환자 자신의 면역T세포를 재프로그래밍하여 암세포를 공격하도록 하는 새로운 개념의 치료제로서 역시 면역 항암치료요법에 사용되는 것 중 하나이다. 2017년도에 tisagenlecleucel1)(티사젠렉류셀; 상품명 Kymriah 킴리아)이 승인된 이후 이미 6종의 CAR-T세포 치료제가 미국 식품의약국(Food and Drug Administration, FDA)에서 승인되어 사용 중이며(Table 1), 우리 나라에서도 현재 tisagenlecleucel과 ciltacabtagene autoleucel(실타캅타젠오토류셀; 상품명 Carvykti 카빅티)이 허가되어 시판 중이다. 게다가 큐로셀을 비롯한 수 종의 CAR-T세포 치료제의 개발이 국내 제약회사에서 진행 중에 있다. CAR-T세포 치료제는 세포 치료제인 동시에 유전자 치료제에 속하며 기존의 의약품들과는 매우 다른 개념의 치료제이다. 이러한 새로운 개념의 치료제는 시대적 요구에 따라 끊임없이 변화하고 성장해 온 약사의 직능에 또 하나의 도전으로 다가온다. 이에 본 지상 강좌를 통해 CAR-T세포 치료제의 개념을 정립하고, 이와 관련된 약사의 역할들에 대하여 살펴보고자 한다.
CAR단백질의 구조와 발전과정
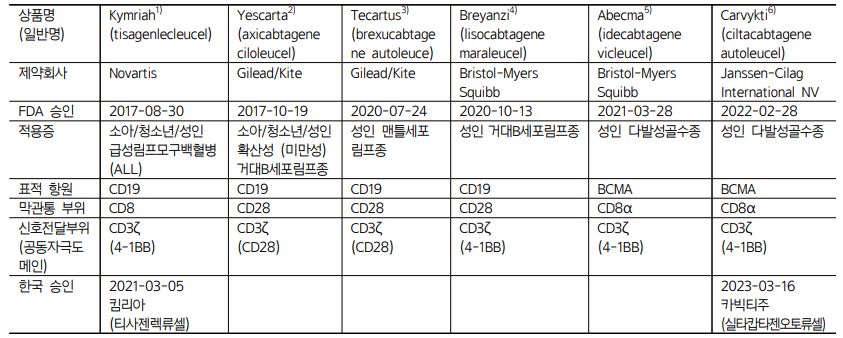
CAR는 키메라(또는 키메릭) 항원 수용체로 번역되는데, 우리가 원하는 특정 항원에 결합하도록 인공적인 방법으로 디자인된 막관통 수용체 단백질이다.7) T세포에 CAR단백질을 발현시키면 이를 CAR-T세포라 하며, 이를 치료제로 사용한다고 해서 CAR-T세포 치료제라 부른다. 키메라 항원 수용체란 이름은 하나가 아닌 여러 단백질의 부분(이를 도메인 domain이라고 표현한다)들을 플러그앤플레이(plug & play) 방식으로 이어 붙여 만들었음을 의미한다. 이렇게 만든 CAR단백질은 크게 1) 리간드 결합 부위, 2) 경첩(또는 힌지 hinge) 영역과 막횡단 도메인을 포함하는 막관통 부위, 3) 신호전달 부위의 3개 영역으로 구성된다(Fig. 1).8) CAR단백질의 리간드 결합 부위에는 특정 항원을 인지하여 결합할 수 있는 도메인이, 막관통 부위와 신호전달 부위에는 리간드 결합으로 시작되는 자극을 세포 내에서 전달할 수 있는 신호전달 도메인이 연결된 것이다. 단백질에서 발견할 수 있는 수많은 도메인은 떼어내서 이어 붙이더라도 일정하게 접힌 상태를 유지하며 그 기능이나 활성을 유지하는 경우가 많다. CAR단백질은 여러 단백질에서 필요한 도메인들을 가져와 연결하여 1)특정한 암세포의 항원에 결합하는 능력이 있고, 이러한 항원과의 결합이 해당 CAR단백질을 갖고 있는 면역세포를 활성화하여 2)암세포를 공격할 수 있도록 한다. CAR단백질이 T세포에서 발현되도록 하면 CAR-T세포가 되고, 자연살해세포(natural killer (NK) cell)에서 발현되도록 하면 CAR-NK세포가 된다. 물론 각 경우에 디자인된 CAR단백질의 구체적인 조성은 다르다.
CAR-T세포가 특정한 암 세포에 대해 면역 반응을 일으키기 위해서는 해당 암에 특이적인 항원이 우선 규명되어야 하며, 이 특정 항원에 결합하는 리간드 결합 부위를 CAR분자에 포함시켜야 한다. 지금까지 승인된 CAR-T세포 치료제는 B세포와 관련된 림프종이나 골수종을 그 치료 대상으로 한다. 총 6개의 CAR-T세포 치료제 중 4개는 CD19를 리간드 결합 부위의 표적 분자로 사용하고 있으며, 2개는 B cell maturation antigen(BCMA)을 표적으로 한다. CD19는 pan-B cell 마커이며, B세포 림프종과 B세포 림프구성 백혈병 치료의 적절한 표적으로 알려져 있다. BCMA 역시 B세포 표면에 존재하는 항원으로 다발성 골수종의 표적 분자로 알려져 있다. CD19와 같은 B세포 표면 항원을 인지할 수 있도록 우선 CD19단백질에 대한 항체를 만들고, 이 항체에서 항원에 결합하는 부위를 CAR단백질의 리간드 결합부위로 사용하게 된다. 리간드 결합부위는 항체의 단일사슬항체조각(single-chain variable fragment, SCFv)이나 나노바디로 알려진 단일도메인항체의 조각(variable heavy chain domains of heavy chain antibody, VHH) 등을 링커 펩티드를 통해 CAR단백질의 막관통 부위에 연결하게 된다.
CAR단백질의 막관통 부위는 엄밀하게는 경첩영역과 막횡단(막관통) 영역을 함께 포함하며, CAR단백질의 세포내 발현 정도, CAR단백질의 안정성이나 신호전달의 문턱 수준 등을 결정한다. 현재까지 CD28단백질이나 CD8α의 막관통 영역이 사용되고 있는데, CAR단백질이 T세포에서 발현되더라도 CD19 또는 BCMA 등 암세포 표면의 항원이 결합하지 않으면 막관통 영역은 별다른 T세포 활성화를 일으키지 않고 대기할 수 있도록 한다. 잘 선정된 막관통 부위는 CAR단백질의 세포 표면 발현을 활성화시키고, 이후 항원이 결합하였을 때 적절한 면역반응이 T세포 내에서 이루어질 수 있도록 한다.
신호전달 부위는 CAR-T세포의 CAR단백질 표면에서 항원이 결합한 이후 세포 내부에서 작동하여 T세포가 적절한 면역반응을 일으킬 수 있도록 한다. CAR-T세포는 T세포가 자체적으로 암세포를 공격하는 기능도 있고, 사이토카인 분비를 통한 면역계 활성화로 다른 면역세포들이 암세포를 공격할 수 있게 한다. 이에 더해 효과적인 CAR-T세포는 환자의 체내에 오래 머물 수 있고, 암세포를 만났을 때 증식되어 암세포와 싸울 수 있어야 하는데, 이러한 과정들을 CAR단백질의 신호전달 부위가 담당한다. 개발 초창기 1세대 CAR단백질은 신호전달 부위에 CD3ζ도메인을 단독으로 사용하였는데, 항원 결합에 반응하여 T세포가 사이토카인을 분비하고 증식하도록 하는 기능이 떨어졌다. 또한 환자에게 이식된 CAR-T세포가 체내에서 지속적으로 생존하지 못하는 단점도 있었다. 후세대 CAR단백질에는 신호전달 부위에 CD28이나 4-1BB(CD137) 등의 공동자극 도메인들이 하나 둘씩 추가되어, 세포 안에서 더 다양한 자극들을 촉진하여 CAR-T세포의 체내 생존기간이 연장되고 항암효과도 향상되었다. 가장 최근 FDA의 승인을 받은 실타캅타젠오토류셀(ciltacabtagene autoleucel; 상품명 카빅티주 Carvykti)의 CAR단백질은 암세포 항원으로 BCMA를 인지하며, 신호전달 부위에는 CD3ζ도메인과 함께 4-1BB도메인을 갖고 있다. 현재 임상에 적용되는 CAR-T세포는 모두 2세대라고 볼 수 있다.
CAR-T세포의 제조
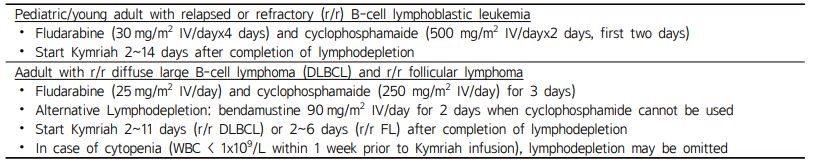
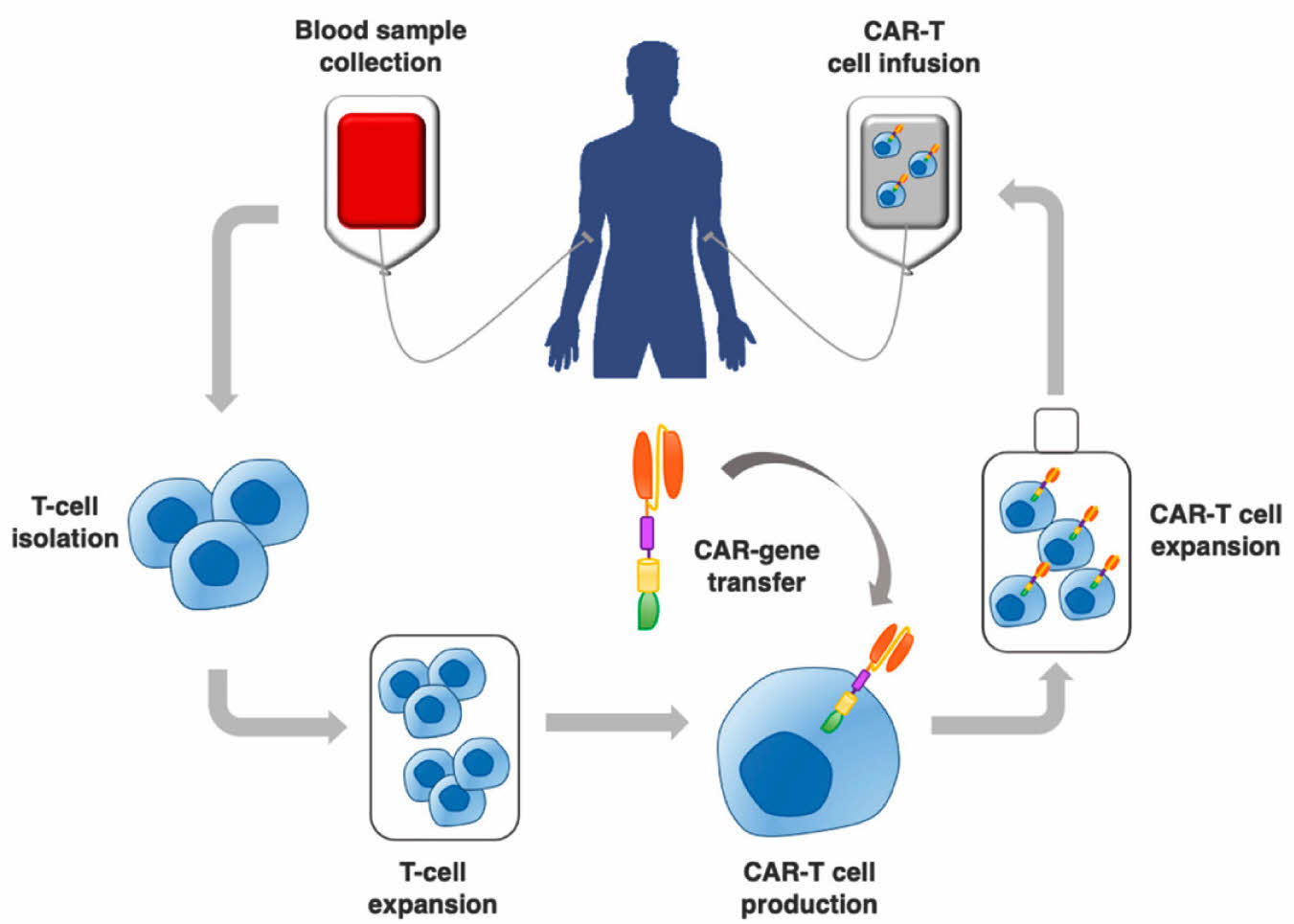
위에서 밝힌 바와 같이 CAR단백질은 인공적으로 디자인한 단백질이다. 환자의 체내에서 CAR단백질을 발현하는 CAR-T세포를 만들기 위해서 우선 T세포를 분리하고, 여기에 CAR단백질을 암호화하는 유전자를 삽입하여야 한다 (Fig. 2).9) 환자에게서 채취한 T세포는 적법한 시설로 옮겨져 CAR단백질을 암호화하는 재조합렌티바이러스 등을 사용하여 형질도입 과정을 거치고 증식시켜 적절한 수의 CAR-T세포를 확보하게 된다. 대략적으로 3-4주의 시간이 소요되며, 국내에서 제일 먼저 승인된 티사젠렉류셀(킴리아)의 경우 이 과정이 아직 국내에서 진행되지 않아 미국 본사로 백혈구를 보낸 후 증식된 CAR-T세포를 받아 환자에게 투여하는 방식을 취한다.
CAR-T세포 치료제의 적용 질환
이미 위에서 밝힌 바와 같이 현재까지 개발된 6종의 CAR-T세포 치료제는 모두 B세포와 관련된 림프종과 골수종 등 혈액암들이다. 또한 아직까지 CAR-T세포 치료제는 1차 치료제가 아니며 불응성, 재발성의 혈액암을 대상으로 하고 있다. 면역세포들로 하여금 암세포를 인지하도록 한 CAR-T세포 치료제가 혈액암에 주로 유효한 이유는 혈액암의 암세포들 자체가 면역계의 일부이기 때문이다. 사람 CD19나 BCMA항원의 경우 정상적인 B세포와 함께 종양 B세포 표면에 있기 때문에 혈액암 특이적인 항원으로 사용하는 것이다. 혈액암이 아닌 고형암에도 CAR-T세포 치료제가 적용될 수 있을 것으로 기대가 되며, 현재 다양한 고형암을 대상으로 한 CAR-T세포 치료제의 임상시험이 진행 중이다. 예를 들어 삼중음성 유방암 환자를 대상으로 EGFR-CAR-T세포를 주입한다면, 적절한 치료제를 찾지 못하던 고형암에 대한 새로운 치료의 문이 열릴 수도 있을 것이다.10) CAR단백질의 표적항원으로 EGFR, HER2, PD-L1 등의 후보가 임상시험 단계에서 연구되고 있다. 이러한 시도들은 적절한 암세포 특이 항원의 선택과 효과적인 면역세포의 활성화가 연결될 때 의미 있는 임상효과로 이어질 것으로 기대된다. 또한, CAR-T세포 치료제가 유망한 것도 사실이지만, 기존의 항암제나 PD-L1 과 같은 표적을 이용하는 다른 종류의 면역항암요법과 비용-편익에 대한 비교가 함께 이루어져야 할 것이다.
CAR-T세포 치료제의 작용 기전
CAR-T세포가 항원을 노출하고 있는 암세포를 공격하는 기전은 일반적인 T세포가 항원을 인식하여 대응하는 기전과 동일하지는 않다. 일반적인 T세포의 경우 주조직 적합 복합체(Major Histocompatibility Complex, MHC)와 함께 표적세포를 제거하는 과정을 거치는데 반해 CAR-T세포는 단독으로 암세포에 노출된 항원을 인지하고 활성화된다. 이 경우 CAR단백질에 존재하는 CD3ζ도메인의 활성화는 일어나지만, MHC에 의한 2차 신호는 없는 상태이다. 이런 이유로 1세대 CAR-T세포는 T세포의 활성화가 제한적이었고, 체내에서 지속적으로 생존할 수 없었다. 이후 공동자극 도메인이 추가되면서 CAR-T세포는 MHC의 도움 없이도 체내에서 오래도록 생존할 수 있고, 보다 효율적인 암세포 독성을 나타내게 된 것이다.
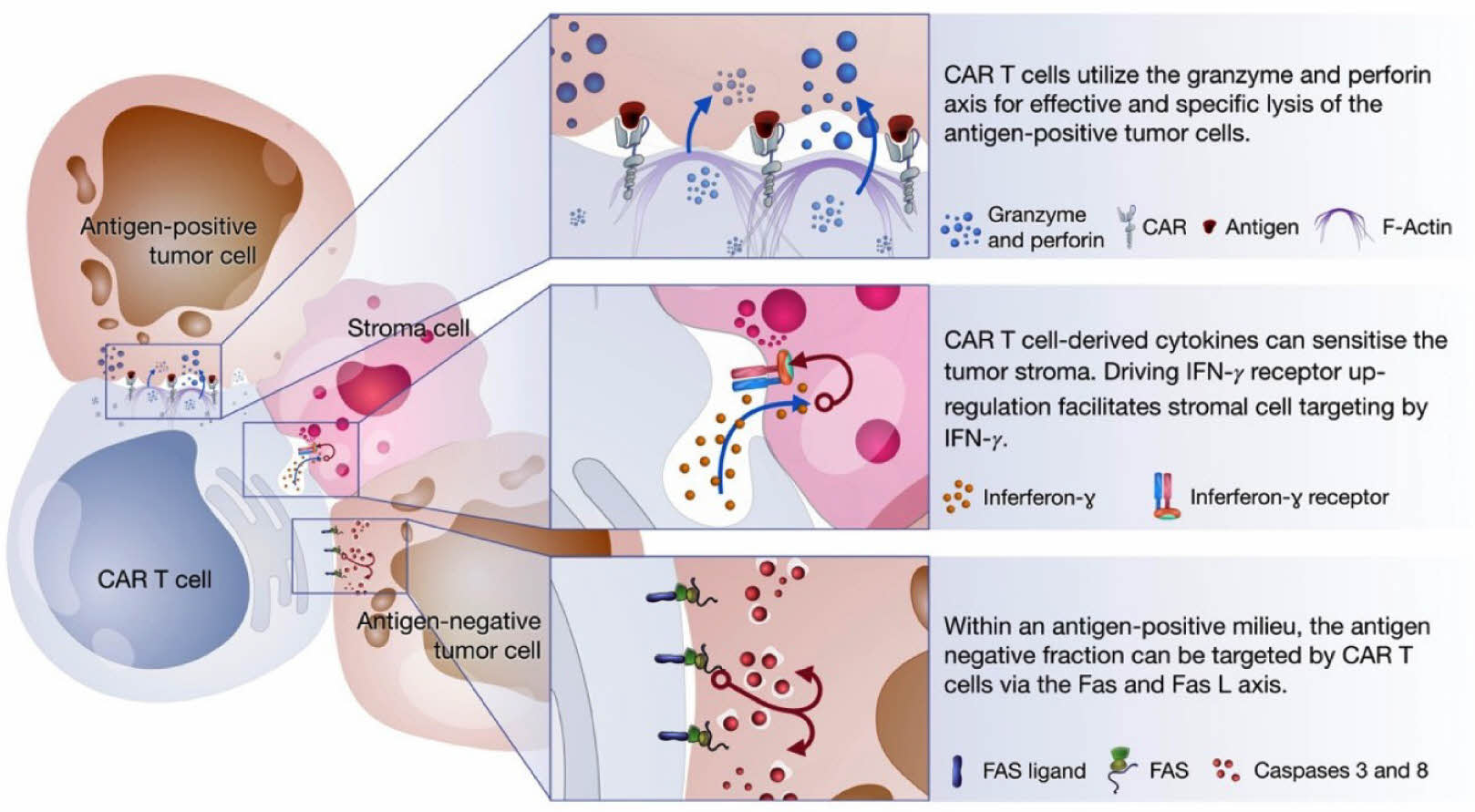
CAR-T세포가 암세포를 사멸시키는 과정을 보면(Fig. 3)11), 우선 특정 항원(B세포의 경우 CD19 또는 BCMA)을 노출하고 있는 세포에 granzyme과 perforin을 분비하여 암세포 표면에 구멍을 내고, caspase활성화를 통해 암세포의 사멸을 유도한다. 또한 CAR-T세포에서 방출되는 인터페론은 종양 간질세포들의 민감화를 촉진한다. 그리고 Fas단백질과 Fas Ligand 상호작용을 통해 암세포의 사멸을 유발할 수 있다. 미세환경에서 Fas-Fas Ligand 상호작용은 특정 항원을 갖고 있지 않은 암세포에도 작용할 수 있다.
T세포 분리와 CAR-T 세포의 환자 투여
-환자의 T세포분리와 CAR-T세포제작: CAR-T세포 치료제의 적용에는 환자의 체내에 있던 T세포를 채취하여 CAR-T세포로 형질도입하고 증식시켜서 주입하는 과정이 필요하다. T세포의 분리는 성분 채혈과 유사한 과정으로 환자의 백혈구를 원심분리하고 여과하여 수집하는 과정이며, 대략 4시간 정도가 소요된다. 이 채혈 과정을 apheresis라고 하며, 백혈구를 수집하는 비닐 백 형태의 용기를 apheresis bag이라고 한다. 이렇게 채취된 T세포는 이후 CAR-T세포 제작 시설로 수송되었다가 개인 환자별로 맞춤 제작되는 CAR-T세포 제작과정을 거친 후에 충분한 수로 증식한 CAR-T세포가 다시 비닐 백 형태의 용기에 포장된다. 포장된 CAR-T세포는 동결된 상태로 보관되며, 액체질소 탱크 안에 담겨서 환자가 치료 받을 의료기관까지 수송된다. T세포의 채취부터 포장된 CAR-T세포가 환자에게 투여 가능한 상태로 수송될 때까지 대략 4주 내외의 기간이 소요된다.
-림프구제거항암요법(Lymphodepletive therapy): CAR-T 세포를 환자에게 투여하기 이전에 림프구의 수를 줄이는 과정을 림프구제거 항암요법이라 하며 림프구 고갈 화학요법이라고도 한다. 림프구제거를 통해 치료 중에 주입하게 될 CAR-T세포를 위한 자리를 마련하고, 환자의 면역체계를 억제하여 주입된 CAR-T세포가 체내에서 지속적으로 유지될 수 있도록 한다는 의미 등을 갖는다. 이 과정에서 CAR-T 치료에 방해가 되는 사이토카인과 백혈구 일부가 제거된다. 방사선 치료, 또는 fludarabine(Flu)나 cyclophosphamide (Cy)와 같은 항암제를 사용하여 림프구제거 항암요법을 실시하게 된다(Table 2). 림프구제거 항암요법은 이후 투여되는 CAR-T세포의 체내 생존기간을 연장하며, 항암 효과도 더 높이는 효과를 갖기 때문에 백혈구 수치가 마이크로리터당 1,000 미만으로 떨어진 경우(cytopenia)가 아니라면 실시하여야 한다. 참고로 백혈구 정상 수치는 마이크로리터당 5~10천 정도이다.
- CAR-T세포투여: CAR-T세포별, 적용 질환별, 환자별로 차이가 있겠으나, 우리 나라에서 제일 먼저 허가된 킴리아를 기준으로 투여 방법을 제시한다. 체중 50kg 이상의 환자의 경우 0.1~2.5×108 CAR-T 세포를 한 번에 점적 주사하는데, 실제 환자에게 투여될 용량으로 준비된 CAR-T세포가 비닐 백 형태의 용기에 포장된 상태로 제약회사에서 의료기관까지 수송된다.
∙CAR-T세포 투여 이전에, 사이토카인 분비 증후군과 같은 부작용 발생 시 사용할 수 있도록 IL-6 억제제인 tocilizumab을 준비한다.
∙킴리아 투여 30~60분 전에 아세타미노펜과 디펜히드라민(또는 다른 H1-항히스타민제)을 투여한다.
∙킴리아는 맞춤의약품으로 다른 환자에게 투여해선 안 된다.
∙킴리아 투여시 분당 10~20mL 속도로 점적 투여한다. 환자에 따라 준비된 킴리아 용기는 10~50mL 가량이다. 투여 시작할 때 0.9% 생리식염수로 주사튜브를 채우며, 용기에 있는 킴리아 의약품을 모두 투여한 이후 10~30 mL의 생리식염수로 린스하여 최대한 많은 세포가 환자에게 투여될 수 있도록 한다.
∙킴리아 투여 직후 일주일 가량은 원내에서 관찰할 필요가 있으며, 4주까지는 환자가 병원 근거리에 머물러 위해반응에 즉각 대응할 수 있도록 한다.
CAR-T세포 치료제의 부작용
CAR-T 세포치료제의 가장 큰 부작용은 사이토카인 분비 증후군(cytokine release syndrome; CRS)과 신경독성(neurological toxicity)이다. CAR-T세포가 활성화되고 증식하면서 이와 동시에 다양한 염증성 사이토카인들이 분비되는데, 이로 인한 과민반응을 CRS라 한다. 발열이나 오한, 저산소증이나 저혈압을 모니터링할 필요가 있으며, 그 밖에 피로, 두통 등의 증상이 있다. CRS 증상은 CAR-T세포 치료제 투여 이후 비교적 초기인 2~3일 내에 발생하여 일주일 정도 지속되는데, 그 심각성에 따라 적절한 대응이 필요하다. 해열제나 진통제, 항구토제, 산소 마스크, 저혈압에 대응하여 혈관수축제나 수액주사 등을 투여할 수도 있고, 아주 심각한 경우 기도 삽관이 필요할 수도 있다. CRS에 대응하여 사용하는 의약품에는 이러한 대증요법제 외에 IL-6 억제제인 tocilizumab, 메틸프레드니솔론과 같은 부신피질 호르몬 등이 있다.
신경독성 역시 빈번한 편인데, CRS가 치료제 투여 후 초기에 발생하는데 반해 신경독성은 CAR-T세포 치료제 투여 후 4~6일에 발생하고, 2주가량 지속된다. 면역세포연관 신경독성증후군(immune effector cell-associated neurotoxicity syndrome; ICANS)은 특히 CRS 증상의 발생기나 회복기에 더욱 조심해서 모니터링할 필요가 있다. 발작 과거력이 있었던 환자, 신생물성 뇌 병변이 있는 경우, 중추신경계 질환이 있는 경우 예방적 차원에서 발작 치료제인 레비티라세탐을 투여할 수 있다. ICANS의 경우 CRS를 동반하는 경우와 단독으로 증상이 나타날 때를 구분하여 적절한 대응이 필요하다.
CAR-T세포 치료제에서 약사의 역할
CAR-T세포 치료제의 사용과 관련하여 약사의 역할은 아래와 같이 나누어 볼 수 있다. 기본적으로 약사의 역할은 환자가 CAR-T세포 치료제로 적절한 치료를 받도록 보장하여 치료 성과를 높이는 데 있다.
- CAR-T세포치료제환자후보군의설정: 환자의 약물치료관리(medication therapy management)를 통해 환자가 CAR-T세포 치료제의 혜택을 받을 수 있는지 그 적정성을 보장하고, CAR-T세포 치료에 앞서서 필요한 검사들이 다 이루어졌는지 확인한다. 이와 함께 환자의 복약기록을 바탕으로 CAR-T세포 치료의 위험성이 없는지 점검한다. 이에는 약물상호작용, 금기 등이 포함될 수 있다.
- CAR-T세포치료제관련환자교육: CAR-T세포 치료제에 대하여 환자와 보호자 수준에 맞는 적절한 정보를 제공한다. 특히 치료제의 장단점을 비교하여 설명한다. CAR-T세포 치료 직후 필요한 의약품 처방을 환자가 잘 따를 수 있도록 교육하고 상담한다. 예상되는 부작용에 대해서도 미리 알려 환자가 당황하지 않고 준비할 수 있도록 한다. 약사는 물론 환자들에게 낯설 수 있는 과정(예를 들어 T세포의 채집 등)들에 대한 전반적인 이해와, 이를 바탕으로 한 환자 교육에 참여할 수 있다.
- CAR-T세포치료제위해반응모니터링: 이와 함께 CAR-T세포 치료제와 관련된 적절한 위해반응 모니터링을 실시한다. 또한 위해반응이 일어날 경우에 사용할 약제에 대한 충분한 준비를 보장한다.
- CAR-T세포치료제약물치료관리: 다른 보건의료인들과 함께 약물요법계획이 적절하게 실행될 수 있도록 조율하며, 약물상호작용과 위해반응을 관리한다. CAR-T세포 치료제를 사용하는 동안 감염 질환을 예방 또는 관리할 수 있도록 적절한 환자 지원을 보장한다. 이에는 항생제나 항진균제가 적절히 처방 투여되고 있는지 확인하는 것을 포함한다. 다른 약물을 함께 복용 중인 환자에 대해서는 다제 약물 관리가 제대로 이루어지도록 보장한다.
- CAR-T세포치료제의의료기관도입: 의료기관에 CAR-T세포 치료제가 처음 도입될 때에는 다른 의약품들과 마찬가지로 약사위원회 등의 적절한 심의 위원회에서 검토를 거칠 수 있도록 한다. 의약품의 안전성과 비용대비 편익 등 정확한 정보를 제공하고, 둘 이상의 CAR-T세포가 도입된다면 각 치료제별 특징을 정확히 파악하여 환자에게 필요한 약이 처방되고 투여될 수 있도록 한다. 병원의 조달 절차에 맞춰 의약품이 계약되고 원내에서 유통될 수 있도록 전산코드를 생성하고, CAR-T세포 치료제에 대한 전반적인 원내 프로토콜의 작성에도 참여할 수 있다.
- CAR-T세포치료제의약제부서내보관과적절한불출: 액체 질소 탱크에 담겨 보관되는 CAR-T세포 치료제의 적절한 보관, 보관 시설에서의 액체 질소로 인한 화재 위험성 등 안전관리, 취급자의 동상 방지 등에 대한 적절한 교육과 관리가 필요하다. 또한, CAR-T세포는 맞춤치료제이기 때문에 다른 환자에게 투여될 경우 매우 심각한 문제가 될 수 있다. 적절한 의약품의 배송과 보관이 이루어질 수 있는 약제 부서 내 시설과 제도가 운영되어야 한다.
|
Fig. 1 Diagram of the CAR-T cell structure 1세대 CAR-T세포 치료제(왼쪽) 암세포의 항원을 인식하 는 리간드 결합 부위가 막관통 부위와 신호전달부위까지 연결되어 암세포와 결합한 CAR-T세포가 활성화되도록 디자인되었다. 2세대 CAR-T세포 치료제(오른쪽)부터는 공동자극도메인이 추가되어 T세포 안에서 다른 신호전달 과정이 동시에 활성화되도록 고안되었으며, 이는 CAR-T 세포의 환자 체내 생존기간을 연장하거나, 암세포가 결합 했을 때 더욱 강력한 면역반응이 일어나도록 한다. |
|
Fig. 2 A brief flow chart of engineered-T cell therapy ① 환자의 혈액을 채취한다. ② T임파구를 분리한다. ③ 분리된 T임파구를 활성화/증식시킨다. ④ 유전자 조작을 통해 CAR/TCR(T cell receptor) 엔지니어링을 한다. ⑤CAR-T세포를 증식시킨다. ⑥ 환자에게 CAR-T세포를 주입한다. |
|
Fig. 3 CAR-T cells mediate tumor killing via three axes ① perforin-granzyme 축 ② 사이토카인 분비 ③ Fas-Fas Ligand 축 |
CAR-T세포 치료제는 아직까지 의료기관들 중에서도 아주 일부 대형병원에서만 사용하고 있지만, 점차 더 많은 의료기관에 보급될 것이다. CAR-T세포 치료제를 비롯하여 기존의 의약품 개념과는 많이 다른 개념의 의약품들은 앞으로 더욱 많이 등장할 것으로 예상된다. 본 지상강좌를 통해 CAR단백질이 어떻게 암세포를 인지하여 T세포 활성화를 유도하는지 간단한 개발과정과 함께 소개하였다. CAR-T세포 치료제의 적용 질환이 아직까지는 혈액암에 머물고 있지만, 다양한 고형암에서 CAR-T세포 치료제를 활용한 임상시험이 진행 중에 있어 더욱 다양한 CAR-T세포 치료제, 또는 CAR단백질 기반의 세포 치료제들이 등장할 것으로 기대된다. 이러한 변화 속에서도 약사들이 역할을 성장시키고 확대해 나갈 때 환자와 대중에게 가치를 제공하는 약사의 모습을 보여줄 수 있을 것으로 믿어 의심치 않는다.
- 1. U.S. Food & Drug Administration. KYMRIAH (tisagenlecleucel) [Internet]. 2022 July 07 [cited 2023 May 12]. Available from: https://www.fda.gov/vaccines-blood-biologics/cellular-gene-therapy-products/kymriah-tisagenlecleucel.
- 2. U.S. Food & Drug Administration. YESCARTA (axicabtagene ciloleucel) [Internet]. 2022 November 11 [cited 2023 May 12]. Available from: https://www.fda.gov/vaccines-blood-biologics/ cellular-gene-therapy-products/yescarta-axicabtagene-ciloleucel.
- 3. U.S. Food & Drug Administration. TECARTUS (brexucabtagene autoleucel) [Internet]. 2022 April 13 [cited 2023 May 12]. Available from: https://www.fda.gov/vaccines-blood-biologics/ cellular-gene-therapy-products/tecartus-brexucabtagene-autoleucel.
- 4. U.S. Food & Drug Administration. BREYANZI (lisocabtagene maraleucel) [Internet]. 2022 July 01 [cited 2023 May 12]. Available from: https://www.fda.gov/vaccines-blood-biologics/ cellular-gene-therapy-products/breyanzi-lisocabtagene-maraleucel.
- 5. U.S. Food & Drug Administration. ABECMA (idecabtagene vicleucel) [Internet]. 2021 April 21 [cited 2023 May 12]. Available from: https://www.fda.gov/vaccines-blood-biologics/abecma- idecabtagene-vicleucel.
- 6. U.S. Food & Drug Administration. CARVYKTI [Internet]. 2023 May 18 [cited 2023 May 18]. Available from: https://www. fda.gov/vaccines-blood-biologics/carvykti.
- 7. Sterner RC, Sterner RM. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer J 2021 Apr 6;11(4):69.
-

- 8. Mazinani M, Rahbarizadeh F. CAR-T cell potency: from structural elements to vector backbone components. Biomark Res 2022 Sep 19;10(1):70.
-

- 9. Guerra E, Di Pietro R, Basile M, Trerotola M, Alberti S. Cancer-Homing CAR-T Cells and Endogenous Immune Population Dynamics. Int J Mol Sci 2021 Dec 30;23(1):405.
-

- 10. Xia L, Zheng ZZ, Liu JY, Chen YJ, Ding JC, Xia NS, Luo WX, Liu W. EGFR-targeted CAR-T cells are potent and specific in suppressing triple-negative breast cancer both in vitro and in vivo. Clin Transl Immunology 2020 May 3;9(5):e01135.
-

- 11. Benmebarek MR, Karches CH, Cadilha BL, Lesch S, Endres S, Kobold S. Killing Mechanisms of Chimeric Antigen Receptor (CAR) T Cells. Int J Mol Sci 2019 Mar 14;20(6):1283.
-

 This Article
This Article
-
2023;9(1):1-7
Published on May 31, 2023
- Received on May 4, 2023
- Revised on May 12, 2023
- Accepted on May 22, 2023
 Services
Services
Shared
 Correspondence to
Correspondence to
- Sang Hoon Joo
-
College of Pharmacy, Daegu Catholic University, Gyeongsan 38430, Korea
Tel: +82-53-850-3614 - E-mail: sjoo@cu.ac.kr