Clinical Information
Clinical Information - Clinical information and medication counseling for influenza treatment: focusing on the comparison between oseltamivir and peramivir
Ji Su Kim†, Gyu Wan Ban†, Yu Jeong Lee†, Jeong Been Lee†, Hyeon Hee Cho†, Se A Cheon†, Yoon Cheol Choi†, Ji Yeon Choi†, So Jin Han†, So Na Hyun†, Huijin Koo, Yun Jeong Lee*
College of Pharmacy, Dankook University
- 인플루엔자 치료제의 임상정보와 복약지도: oseltamivir와 peramivir의 비교를 중심으로
김지수†, 반규완†, 이유정†, 이정빈†, 조현희†, 천세아†, 최윤철†, 최지연†, 한소진†, 현소나†, 구희진, 이윤정*
단국대학교 약학대학
This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Oseltamivir and peramivir are neuraminidase (NA) inhibitors that were widely used to treat influenza virus infections during the 2023-2024 influenza season in Korea. Oseltamivir is administered orally twice daily for 5 days, while peramivir can be given as a single intravenous injection over at least 15 minutes for treatment of influenza A or B virus infection. In clinical studies comparing oseltamivir and peramivir, many studies have shown that there is no difference in the influenza treatment efficacy between the two drugs, while some studies have reported that peramivir or oseltamivir is superior. Gastrointestinal adverse reactions were commonly reported with both drugs, and neuropsychiatric events were reported in pediatric patients after oseltamivir administration, raising the need for close monitoring of pediatric patients when using NA inhibitors. However, there were no significant differences in complications or major safety concerns between the two drugs. In Korea, peramivir is not covered by insurance and is more costly than oseltamivir. When selecting the appropriate treatment for influenza virus infection treatment in individual patients, medication efficacy, safety, convenience, and cost should be comprehensively examined, and appropriate medication counseling should be performed.
Keywords: Influenza, oseltamivir, peramivir, treatment, efficacy, safety
인플루엔자는 매년 수십만 명의 사망을 유발하는 주요 감염병으로, 최근 국내 유행이 지속되고 있어 예방과 치료 대책 마련이 시급하다.1) 특히 고위험군 대상 백신 접종과 효과적 치료제 사용이 중요한 과제이다. 원인 병원체는 RNA 바이러스로 A, B, C, D형의 4가지 형태가 있으며 A형과 B형이 사람에게 주기적 유행을 일으킨다. 이 두 형은 바이러스 구조와 역학적 특성에서 차이가 있다.2) 인플루엔자 A형 바이러스는 hemagglutinin (HA)과 neuraminidase (NA) 단백질의 항원 변이로 다양한 아형이 존재하며, 현재 18종 HA와 11종 NA 아형이 확인되어 있다.3) 이와 달리, 인플루엔자 B형 바이러스는 Victoria와 Yamagata 두 계통으로 나뉘고, 주로 소아와 청년층에서 발병하며 A형에 비해 전파력은 약하지만 계절 유행의 25-35%를 차지한다.4-5) 또한, A형과 B형 모두 발열, 기침, 인후통 등의 전형적 증상이 나타나지만, A형 환자에서 전신 증상이 보다 심한 경향이 있으며 반대로 B형은 소아에서 급성 호흡기 증상이 심할 수 있다.6-8)
최근 국내에서는 인플루엔자 A형과 B형 바이러스가 주된 유행 원인체로 나타나고 있다. 2022-2023년에는 A/H3N2 아형이 가장 많이 검출되었지만, 2023년 4분기부터 2024년 1분기까지는 B형의 검출률이 A형보다 높았다.9-10) 이처럼 국내에서 A형과 B형 인플루엔자 바이러스가 시기별로 유행을 주도하고 있으며, 이러한 인플루엔자 바이러스는 주로 감염자의 비말핵을 흡입하거나 오염된 물체를 만져 전파된다.11) 감염에 대한 진단법은 배양검사, 항원/항체 검출, 분자진단 등 다양한 방법으로 진단할 수 있고, 최근에는 RT-PCR을 이용한 분자진단법이 가장 널리 사용되고 있으며, 특히 Real-time RT-PCR과 Multiplex RT-PCR이 주목받고 있다. 이 중 Real-time RT-PCR은 정량 분석이 가능하고, Multiplex RT-PCR은 A형/B형 및 아형을 동시에 구분 검출할 수 있는 장점이 있다.9,11-12)
예방을 위한 인플루엔자 백신은 매년 세계보건기구(World Health Organization, WHO)가 선정한 바이러스주를 포함하도록 제조된다.13) 이때, 전통적인 3가 백신은 2종의 A형과 1종의 B형 바이러스를 포함하지만, B형에 두 가지 주요 계통이 있어 한계가 있었으며,15-16) 이후 이를 보완하기 위해 A형 2종, B형 2종을 모두 포함한 4가 백신이 개발되었다. 인플루엔자 백신은 6개월 이상 모든 연령에서 매년 접종이 권장되며, 특히 노인, 임신부, 기저질환자 등 고위험군에 특히 더 강조된다.14-17) 이때 접종 방법으로는 근육주사가 가장 일반적이며 이외에도 피내주사(intradermal, ID), 피하주사(subcutaneous, SC), 비강분무(nasal spray) 등이 있다. 비강분무 백신18)의 경우 약독화 생백신(Live Attenuated Influenza Vaccine, LAIV)으로, 대표적인 제품으로 아스트라제네카의 ‘플루미스트’가 있으며, 2024년 9월 미국 식품의약국(Food and Drug Administration, FDA)에서는 추가적인 연구 결과를 토대로 해당 백신을 2~49세 소아 및 성인을 대상으로 가정에서도 자가 투여할 수 있도록 허가하여, 온라인 약국을 통해 환자가 의뢰시, 약사가 적절성을 검토한 후, 집으로 직접 배송받을 수 있게 된다.19) 인플루엔자 백신의 예방효과는 40-60% 수준이지만, 건강한 성인에서는 70-90%로 높고 65세 이상 노인에서는 17-53%로 낮은 편이다.15,20) 이에 노인에서 효과를 높이기 위해 고용량 항원 백신과 면역보조제 첨가 백신이 도입되었다.21-13)
인플루엔자 치료를 위한 항바이러스제는 여러 종류가 개발되었고, 현재 국내에서 허가된 인플루엔자 치료제로는 oseltamivir, peramivir, zanamivir, baloxavir marboxil 등이 있으며, 기존의 amantadine과 rimantadine은 내성 발현 및 부작용으로 인해 더 이상 권고되지 않는다.24) Amantadine은 내성 바이러스가 급증하면서 2018년 국내 허가가 취소되어 현재는 사용이 불가능한 실정이다.25) Rimantadine 역시 내성 바이러스 유행으로 인해 2006년 1월 17일 사용 중지 권고되었다.26-27)
Oseltamivir는 인플루엔자 A와 B 바이러스 감염증 치료를 위해 가장 널리 사용되는 경구용 NA 억제제이다.28) 2000년 6월 처음 국내 허가를 받은 이후 현재까지 가장 선호되는 인플루엔자 치료제로 자리매김하고 있으며, 1세 이상 모든 연령에서 5일간 1일 2회 투여한다.29) Peramivir는 인플루엔자 A와 B 바이러스 감염증 치료를 위한 단회 정맥내 주사제이다. 2010년 국내에서 인플루엔자 치료제로 허가를 받았으며, 19세 이상 성인에서 단회 600 mg 정맥주사한다.30) Zanamivir는 인플루엔자 A와 B 바이러스 감염증 치료를 위한 흡입 투여용 NA 억제제이다.31) 2000년 4월 국내에서 인플루엔자 치료제로 허가를 받았으며 5세 이상에서 치료 시 1일 2회, 예방 시 1일 1회 흡입한다.32) Baloxavir marboxil은 최근 개발된 인플루엔자 바이러스 캡의존성 엔도뉴클라아제 억제제이다. 2021년 국내에서 인플루엔자 A 및 B 바이러스 감염증 치료제로 허가를 받았으며, 12세 이상에서 단회 40 mg 또는 80 mg 투여한다.33) 마지막으로 laninamivir는 NA 억제제 계열의 인플루엔자 치료제로, 현재 국내에서는 아직 허가되지 않은 상태이지만, 일본에서는 2010년 인플루엔자 치료제로 승인을 받아 사용 중에 있다.34) 투여 경로는 단회 정맥주사 요법이며, 체중에 관계없이 고정 용량인 600 mg을 단회 정맥주사한다.35)
2023-2024 절기 인플루엔자 시즌 동안, 국내에서 인플루엔자 주사제 peramivir의 수요가 크게 증가하면서 일시적으로 공급이 부족한 상황이 발생했다. 이에 질병관리청은 peramivir를 수급 불안정의약품으로 지정하고 수급 대책을 마련하기도 했다.36) Peramivir는 단일 정맥 내 주사로 투여되는 인플루엔자 치료 바이러스제로, 경구 복용이 어려운 환자에게 유용한 치료 옵션으로 주목받고 있다.37)
Oseltamivir와 peramivir 두 인플루엔자 치료제는 효과, 안전성 등의 측면에서 일부 상이한 특성을 보이고 있지만, 현재까지의 연구 결과만으로는 두 제제의 장단점을 명확히 구분하기 어려운 실정이다. 특히 최근 국내 인플루엔자 유행 상황과 peramivir 수요 급증을 고려할 때, 국내 실정에 맞는 두 제제의 비교 연구가 필요해 보인다. 이에 본 논문에서는 oseltamivir와 peramivir 두 치료제에 대한 국내외 최신 문헌을 심도 있게 검토하여, 각 제제의 효과, 안전성, 복약지도 측면에서의 특성을 종합적으로 비교 분석하고자 한다.
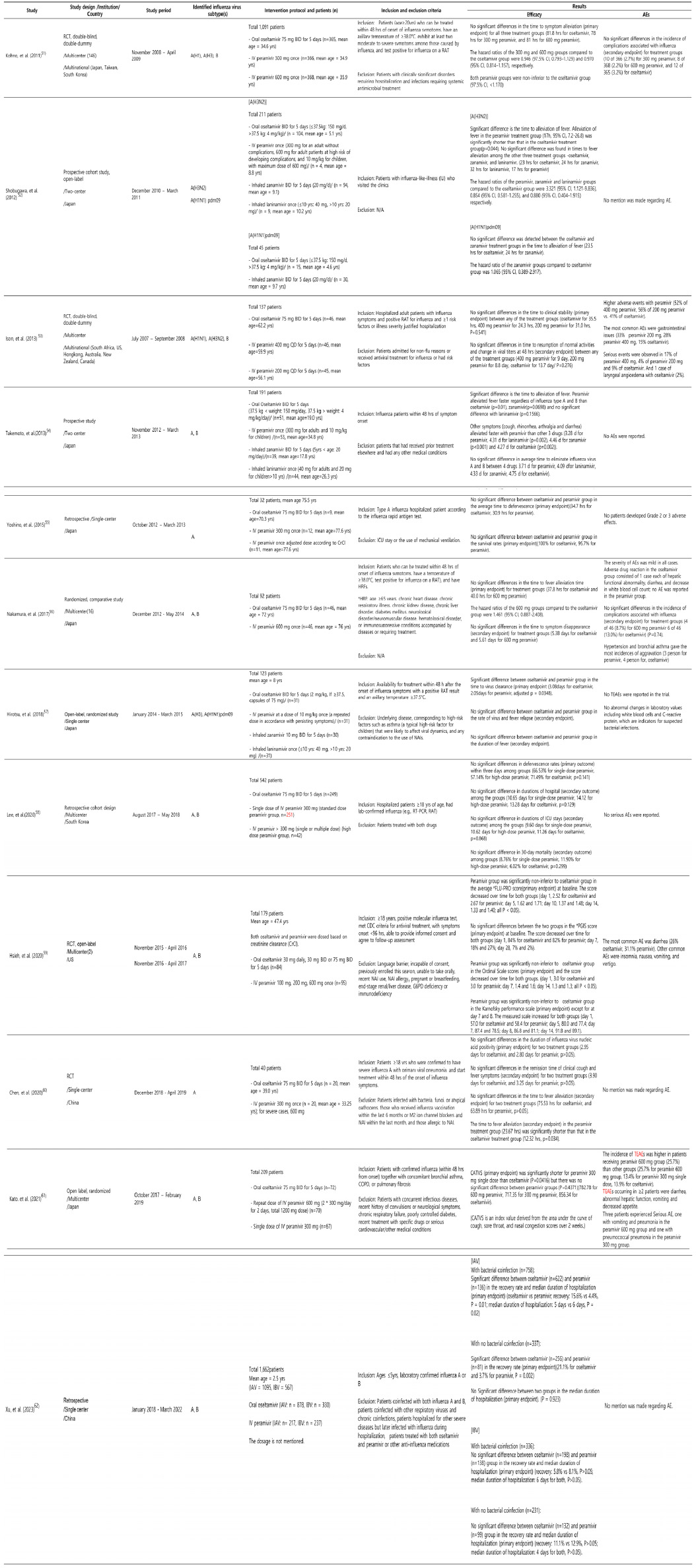
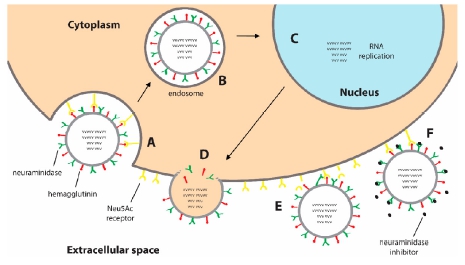
Oseltamivir와 peramivir의 두 약물은 NA 억제제로, 약물 기전은 인플루엔자 바이러스의 생활사(Fig. 1)를 통해 이해할 수 있다. 인플루엔자 바이러스는 출아 후, 바이러스 표면의 HA가 숙주세포의 Neu5Ac (시알산) 수용체에 결합한다. 이후 NA는 Neu5Ac를 가수분해하여 인플루엔자 바이러스가 방출되게 한다(Fig. 1의 E). NA의 활성은 NA 억제제에 의해 저해되어 인플루엔자의 방출을 방지하여 병원성을 감소시킨다. Oseltamivir와 peramivir는 시알산의 유사체로, 시알산 대신 NA에 경쟁적으로 결합하여 NA 억제제의 기능을 한다(Table 1, Fig. 2).38) 따라서 NA가 시알산을 가수분해하지 못하도록 하여 인플루엔자 바이러스의 방출을 억제함으로써 결국 증식을 억제하는 것이다(Fig. 1의 F). 인플루엔자 바이러스는 감염 후 72시간 내에 증식이 일어난다. 바이러스의 증식을 억제하기 위해서는 초기 증상 발현 또는 감염자와 접촉한지 48시간 내에 약 복용 시 추가적인 바이러스의 증식을 막아 최적의 치료효과를 기대할 수 있다.39)
두 약물의 기전은 동일하나, 기질인 NA와 결합하는 방식에서 조금 차이가 있다. Oseltamivir는 극성보다는 강력한 소수성 상호작용에 의존하여 NA에 결합한다.41) 반면에 peramivir는 oseltamivir와 유사하게 강력한 소수성 상호작용을 함과 동시에, 추가적으로 구아니디노 그룹과 NA 활성부위의 산성 그룹간에 안정적인 수소 결합 및 정전기적 상호 작용을 형성한다. 이러한 상호 작용과 peramivir와 그 표적 사이에 형성된 추가 결합으로 인해 peramivir는 NA 활성 부위에 대한 높은 친화성으로 단단히 결합하여 oseltamivir에 비해 더 긴 반감기(t1/2 7.7 to 20.8 hour)를 가진다(Table 1).38,42) 따라서 peramivir는 긴 반감기로 인하여 단회투여가 가능하다.43-44)
|
Fig. 1 Mechanism of action of oseltamivir and peramivir40) |
|
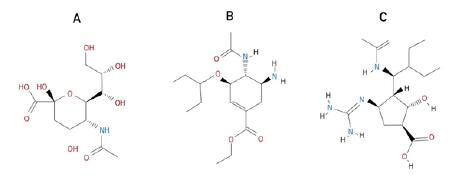
Fig. 2 Chemical structures of A. sialic acid and neuraminidase inhibitors B. oseltamivir and C. peramivir |
Oseltamivir는 생후 2주 이상의 환자에서 인플루엔자의 치료, 1세 이상의 환자에선 예방 목적으로 승인되어 현재 캡슐, 산제, 경구용 현탁액 제형으로 시판되고 있다(Table 1).38,46)
FDA과 식품의약품안전처(식약처)에 따르면 인플루엔자 치료를 위해서는 증상 발생 후 48시간 이내에 oseltamivir 혹은 peramivir 투여를 시작해야 한다. Oseltamivir의 용량은 연령대에 따라 다르다. 성인 및 청소년(만 13세 이상)은 오셀타미비르 인산염 캡슐을 경구로 5일간 매일 2회 75 mg 복용(75 mg 캡슐 1개 또는 경구 현탁액 12.5 mL 2회)이 권장된다. 소아환자(만 2주-만 12세)는 체중에 따라 다른 용량(≤15 kg: 30 mg, >15.1 kg-≤23 kg: 45 mg, >23.1 kg-≤40 kg: 60 mg, ≥40.1 kg: 75 mg)이 권장된다. 생후 2주에서 1년 사이의 소아 환자의 경우 3 mg/kg의 경구 현탁제 투여가 권장된다(Table 1).38,45-48)
인플루엔자의 예방요법은 지역사회 감염 또는 인플루엔자 감염자와 밀접 접촉한 경우에 해당된다. 노출 후 48시간 이내에 복용해야 하며, 예방 권장 기간은 10일로 지역사회 발병(계절적/노출 전) 예방의 권장 기간은 최대 6주[면역 저하 환자(고형 장기 또는 조혈모세포 이식 환자)의 경우 최대 12주]이다. 1회 투여에 대한 예방적 용량은 치료적 용량과 동일하지만, 예방 용법은 1일 1회로 총 투여 용량이 치료 용량의 절반이다.46)
Oseltamivir의 용량 조절은 신장 장애 환자(eGFR≤60 mL/min)에게 필요하다. 중등도(eGFR: 30-60 mL/min)의 신장 장애 환자에서는 30 mg을 1일 2회 5일간 투여로 치료용량을 감량하는 반면 중증(eGFR: 10-30 mL/min)의 환자에게는 1일 1회 30 mg로 5일간 투여가 권장된다. 주기적으로 혈액투석을 받는 말기 신질환 환자는 이 약 30 mg을 즉시 복용 후 투석 때마다 30 mg을 투여하고 투석을 받지 않는 환자에 대해서는 복용을 권장하지 않는다.45-46)
Oseltamivir와 대조적으로 peramivir는 인플루엔자 치료에만 승인되어 용액과 프리믹스 제형이 있다(Table 1).47) 국내에서는 무균 조건에서 최종 부피가 60-100 mL가 되도록 멸균 생리식염주사액으로 희석하여 peramivir 용액을 조제한다.48) 반면에 FDA는 최종 농도가 1-6 mg/mL가 되도록 0.9% 또는 0.45% NaCl, 5% dextrose 또는 Lactated Ringer 용액을 사용하여 조제하도록 권장한다. 이때 최대 주입 부피는 환자의 체중에 따라 조절한다. Peramivir는 밀봉용기에 상온(1-30℃) 보관하되, 사용하지 않은 희석액은 희석 24시간 후 폐기가 원칙이다. 따라서 희석 후 즉시 투여하거나 냉장 조건(2-8℃)에서 최대 24시간 보관이 가능하다. 냉장 보관 시 peramivir 용액이 실온에 도달하도록 한 다음 즉시 투여한다.48)
Peramivir의 용량 또한 연령대에 따라 다르다. 식약처와 FDA는 성인 및 청소년(만 13세 이상) 환자에게 600 mg의 단일 용량을 정맥 주사를 통해 15-30분에 걸쳐 투여하는 것을 권장하고 있다.47-48) 그러나, 소아환자의 경우 투여용량이 다소 상이하다. 식약처는 소아환자(2세 이상)에게 10 mg/kg (최대용량 600 mg)의 용량 투여를 권장하고 있지만,47) FDA는 소아환자(만 6주-만 12세)에서 12 mg/kg(최대용량 600 mg)의 단일 용량을 권장한다(Table 1).42) Peramivir는 신기능 장애가 있는 성인에서 약물 노출이 상당히 증가하기 때문에 eGFR<50 mL/min 인 환자에게 투여 시 용량 조절을 해야 한다.47-48)
Oseltamivir를 주성분으로 하는 많은 의약품들이 급여 혜택을 받는 반면에 peramivir는 국내 시장에 17개의 의약품 모두가 비급여로 취급되고 있으며, 이로 인해 두 의약품 간의 약가가 상당한 차이가 있다.49) 예를 들어, oseltamivir의 경우 캡슐(75 mg) 1개 기준 약값은 1,053원에서 1,731원 범위에 있으며, 현탁용분말은 50 mL당 126원에서 148원으로 책정된다. 한편, 산제의 경우 30 mg 1포 기준 약값은 726원에서 854원이다.49) 이와는 대조적으로 peramivir의 경우, 비급여로 기관에 따라서 2024년 기준 의원급은 8~12만원, 응급실은 15~17만원 정도의 투약비용이 들 수 있다.50) 이러한 가격 차이로 인해 성인 기준 인플루엔자 바이러스 치료의 총 약값을 비교할 때 oseltamivir 캡슐의 경우 10,530원에서 17,310원, peramivir는 약 8~17만원으로 peramivir 투여시 훨씬 더 많은 비용이 발생하게 된다(Table 1).
Oseltamivir과 peramivir를 비교하는 임상연구는 인플루엔자에 감염된 환자들을 대상으로 여러 환경에서 진행되었으며, 주요 연구 결과는 Table 2에 요약하였다.51-62) 임상연구는 성인 외에도 소아,52,57,62) 만성 호흡기 기저 질환을 가진 환자,61) 입원 환자,53,55,58) 합병증이 있는 고위험군 환자56,59,60) 등 다양한 환자군을 대상으로 진행되었다. 연구 결과, 일부 연구는 두 약물간 임상 결과에 차이가 없다는 결과가 나왔으며, 이때 평가한 지표로는 인플루엔자 증상 완화 시간,51,57,60) 해열,55,56,57,58) 바이러스 농도 변화,53,57,60) 임상적 안정성까지 걸리는 시간,53) 일상 활동 재개까지의 시간,53) 생존률,55) FLU-PRO 점수, Ordinal Scale, Patient Global Impression on Severity Score (PGIS) 및 Karnofsky Performance Scale59) 등이 있다.
반면, 일부 연구에서는 peramivir의 치료 효과가 우월하다는 결론을 내렸으며, 평가한 지표로는 해열까지의 시간,52,54,60) 인플루엔자 증상 완화 시간,54,62) 바이러스 제거까지의 시간,57) 증상 대비 누적 면적비(CATVS),61) 입원 시간 단축62) 등이 있다.
또한 한 연구에서는 oseltamivir의 치료 효과가 우월하다는 결론을 내렸으며,62) 이는 인플루엔자 바이러스에 감염된 유아(0-5세) 환자 중 인플루엔자 A 바이러스에 감염된 환자들의 임상 회복률 및 입원 기간이 oseltamivir에서 우월했다. 다만 인플루엔자 B 바이러스에 감염된 그룹에서는 이러한 임상지표에 두 약물군간 유의한 차이가 발견되지 않았다.62)
인플루엔자와 관련된 합병증 및 약물이상반응에 있어서 여러 연구들이 oseltamivir과 peramivir간의 차이가 없다고 보고하였으나,51,55,56) 일부 연구에서는 peramivir의 이상반응이 더 많이 보고되었다.53,61) 흔하게 보고된 약물이상반응으로는 위장관계 이상반응(설사, 구역/구토), 불면증 등이 있었다.
이렇듯 oseltamivir과 peramivir의 효과 및 안전성에 대해 상반된 연구결과가 존재하는 가운데, 한 연구에서는 peramivir의 비용이 5일간 oseltamivir 치료요법의 6배가 소요되며, 더 많은 비용 효과성 연구의 필요성에 대해 언급하기도 하였다.59)
Oseltamivir
Oseltamivir의 성인/청소년의 치료에서 가장 빈번히 보고된 약물 이상반응은 구역(10%), 구토(8%), 두통(2%) 및 전신 통증(<1%)이었다(Table 3).45) 성인/청소년의 예방에서 가장 빈번히 보고된 이상반응은 두통(17%), 구역(8%), 통증(4%) 및 구토(2%)이었다(Table 3). 소아의 경우 가장 빈번하게 보고된 약물이상반응은 구토였으며, 이러한 약물이상반응은 약 복용을 중단할 정도에 이르지 않았다. 대부분의 이상반응은 일회성이었고 투여 첫날 혹은 이틀 째에 발생, 이후 1~2일내에 해소되었다. 국제의약용어(MedDRA) 분류상 흔함(≥1/10) 이상의 빈도로 보고된 이상반응은 Table 3과 같다.45)
Oseltamivir를 복용한 환자 중 1% 미만의 환자에서 불안정형 협심증, 빈혈, 위막성 대장염, 환각, 폐렴 등의 이상사례가 발생하였다.45) Oseltamivir와 peramivir 투여 후 아나필락시스, 스티븐슨-존슨 증후군 및 독성 표피 괴사 증후군의 심각한 피부 반응이 보고된 바 있으나, 그 발생빈도는 명확하지 않다.45,47)
Peramivir
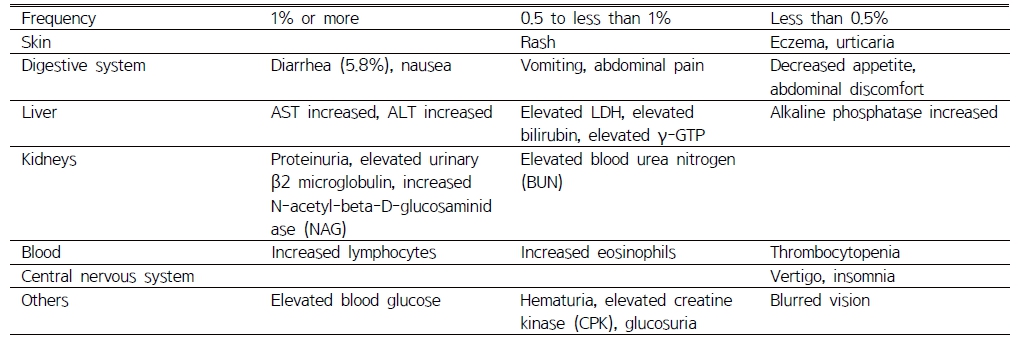
성인을 대상으로 한 임상시험 결과 주요 이상반응 증상은 설사(5.8%), 호중구 감소(2.8%) 단백뇨(2.5%)였다(Table 4).47) 소아를 대상으로 한 임상시험 결과 설사(10.3%), 호중구감소(11%), 구토(5.1%)가 흔하게 보고되었다.47) Peramivir 투여 시 1~5% 미만의 빈도로 백혈구 감소, 호중구 감소 등의 중대한 이상반응이 보고되었다. 또한 정신・신경 증상(의식장애, 이상행동, 섬망, 환각, 망상, 경련 등)의 중대한 이상반응이 oseltamivir와 같은 유사 제제에서 보고되었으므로, 관찰을 충분히 실시해야 한다.47) 그 외의 이상반응은 Table 4과 같다.47)
정신신경학적 이상사례
인과성은 명확하지 않으나, oseltamivir의 투여로 인해 정신신경계 증후군이 발생하여 사망으로 이르는 사례가 주로 10세 이상의 일본 소아에서 보고되었다.63) 이에 식약처는 2007년도에 관련 이상반응과 이상행동에 의한 사고의 위험성을 경고 문구에 추가하였다.64)
그러나 이후 연구에 의하면 oseltamivir와 신경정신학적 사건(neuropsychiatric Events, NPE)과의 연관성 입증이 어렵다는 연구 결과가 보고되고 있다.65-66) 기존 연구들은 표본 크기가 작고 이러한 사례들이 드물게 일어난다는 점 등에서 신경정신학적 사건 발생이 oseltamivir에 의한 것인지 인플루엔자에 의한 발생인 것인지 구별하는 것이 어렵다고 판단하였다.65)
식약처는 2017년 5월 oseltamivir 복용 후 소아 및 청소년 환자의 정신신경학적 이상사례 발현에 대하여 모니터링 하도록 허가사항에 반영하였다. 이후 2018년도에 약물과의 인과관계는 불명확하지만, 전문가 및 국민들에게 주의사항 당부 목적의 안전성 서한을 배포하였다.64) 2020년도에 배포된 안전성 서한에서는 대상 품목이 기존의 oseltamivir 뿐만 아니라 peramivir, zanamivir까지 확장되었다.67)
|
Table 3 Adverse drug reactions of oseltamivir versus placebo in influenza treatment and prophylaxis trials45) |
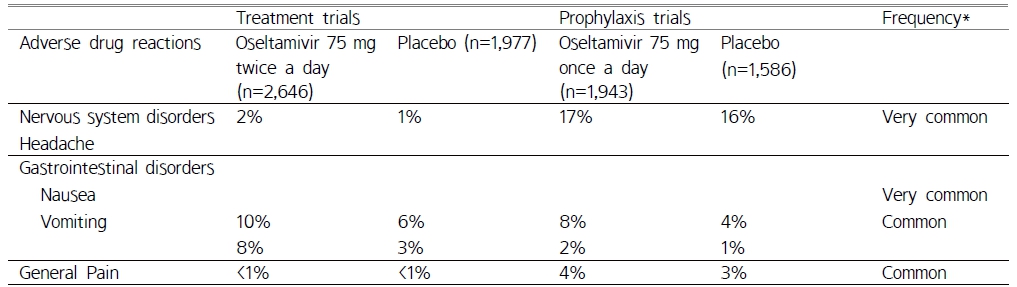
*Frequency was reported only for oseltamivir group |
Oseltamivir
이 약물은 인플루엔자 백신을 대신할 수 없고, 인플루엔자에 대한 예방 효과는 이 약을 사용하는 동안에만 지속된다.45) 해당 약물 복용 환자 중 주로 소아/청소년 환자에서 경련 및 섬망과 같은 신경정신계 이상반응이 보고되었으므로, 사고로 이어지지 않도록 면밀히 모니터링 한다.45) 소아 및 청소년 환자에게 투여 시 만일의 사고를 방지하기 위하여 적어도 2일간은 보호자가 함께 있도록 하며, 부작용이 발생하는 경우 즉시 알릴 것이 권고된다.63) 고위험군 환자(천식, 만성 기관지염, 면역억제)는 사용 경험이 매우 드물기 때문에 신중히 투여한다.45)
Oseltamivir는 임부의 경우 인플루엔자 고위험군에 해당한다. 임신 중인 여성이 oseltamivir와 같은 항바이러스 약물에 대해 기술된 보고서는 제한적이며, 임신 기간 중 발달 독성에 중대한 위험을 시사하지 않는다.45),68) 임부의 경우 인플루엔자 고위험군이므로 임부 또는 임신 가능성 있는 여성이 oseltamivir를 복용할 경우에는, 치료상의 유익성이 위험성을 상회하여야 한다.45) 수유기 랫트 동물실험 자료로부터 oseltamivir와 활성대사체가 유즙으로 분비된다는 점이 밝혀졌으나, 배출되는 약물의 양이 적고 치료양보다 저용량으로 나타났다.45) 이러한 정보와 수유부의 상태를 고려하여 치료상 유익성이 위험성을 상회하는 경우, 투약을 고려할 수 있다.45)
Peramivir
점적정주용 제제이므로 다른 항인플루엔자 바이러스 제제(경구제, 흡입제 등)의 사용을 고려한 후 약의 투여 필요성을 검토한다.47) Peramivir는 예방투여에 있어서 유효성 및 안정성이 확립되어 있지 않다.47) 이 약을 포함하여 NA 억제제로 치료받은 인플루엔자 환자들 중 주로 소아 및 청소년 환자에서 경련, 발작, 섬망, 환각 등 신경정신계 이상반응이 보고되었으므로 해당 이상행동 발현에 대해 면밀히 모니터링한다.47) 배합 변화 시험을 실시하지 않았으므로, 다른 정맥내 주사용 약제등과의 배합 또는 같은 정주라인으로의 동시 주입은 피해야 하며, 조제 후 즉시 투여한다.47) 고령자의 경우 사용한 경험이 드물어 신중히 투여해야 한다.47) 심장, 순환기능 장애가 있는 환자의 경우 주사용수 첨가물에 의해 심장에 부담이 증가되어 증상이 악화될 염려가 있으므로 신중 투여한다.47)
Peramivir는 임부에서의 약물 사용과 관련된 적절한 연구가 수행되지 않았다.47) Peramivir는 임부금기 2등급으로, 태아에 대한 위해성이 나타날 수 있으므로 원칙적으로 사용 금지된다.69) 다만, 인플루엔자 고위험군인 임부에 대한 치료적 유익성이 위험성보다 더 높을 경우 신중하게 투여 가능하다.69) 랫트를 이용한 동물실험에서 peramivir가 유즙 중에 이행하는 것이 보고되었으므로, 수유부에게 투여할 경우에는 수유를 피한다.47)
Oseltamivir와 peramivir 모두 각각 이 약 또는 약의 구성성분에 대한 과민반응 환자의 경우 투여가 금기된다.45,47)
Oseltamivir
약리 및 약동학 시험 결과, 임상적으로 유의성 있는 약물 상호작용은 없을 것으로 예상된다.45) 제산제, 진통제, 베타차단제, 항생제, 안지오텐신 전환 효소 억제제 등 통상 사용되는 약물과 함께 투여하여도 이상반응의 종류나 빈도에 변함이 없었다.45)
Oseltamivir과 비강투여 LAIV과 동시 사용은 평가되지 않았다.45) 그러나 항바이러스제인 oseltamivir가 생백신 바이러스의 복제를 억제하여 백신의 효능을 감소시킬 가능성이 존재한다.46) 이러한 제제 간 잠재적 영향때문에 의학적으로 입증된 경우를 제외하고 LAIV를 oseltamivir 투여 전 2주 이내 또는 이 약 투여 후 48시간 이내에 투여해서는 안 된다. 반면, 비활성화 인플루엔자 백신은 이 약 사용과 관련하여 언제든지 투여 가능하다.45,46)
국내 허가사항은 미국 FDA와 약간의 차이를 보였다. 능동 신배설을 통해 배설되는 약물 중 chlorpropamide, methotrexate, phenylbutazone과 같은 안전역이 좁은 약물의 경우, 병용 투여 시 주의해야 한다.45) 기질이 신세뇨관으로 분비되는 ganciclovir와의 상호작용이 시판 후 보고되었다.45)
Warfarin의 경우 국내 식약처 및 미국 FDA 허가 사항에는 약물 동태 변수에 유의미한 변수가 없고, 용량 조절이 필요 없다고 언급되었다.45,46) 그러나 2012년에 보고된 후향적 연구에 의하면 oseltamivir와 warfarin의 상호 작용 가능성이 제시되었다.70) Oseltamivir는 알려지지 않은 기전을 통해 warfarin의 출혈 위험을 증가시킬 수 있다. Warfarin 복용 환자에게 oseltamivir 투여 시 INR 수치가 상승하였고, INR 증가군에서 일부 환자에서 출혈 사례(피가 섞인 가래, 혈성 복수 등)가 보고되었다.70) 그러나 이는 후향적 연구로 얻은 결과이므로, 환자의 INR 수치 상승이 약물-약물 또는 약물-질병(인플루엔자 감염)의 상호작용에 의한 것인지 입증하기 어렵다.70) 그럼에도 불구하고 두 약물을 병용하는 동안 독성 증가 사례가 여러 차례 보고되고 있다. 따라서 이러한 상호작용이 완벽히 입증될 때까지 주의가 필요하며, warfarin과 oseltamivir를 함께 처방받은 환자에 대해 INR을 면밀히 모니터링하는 것이 권고된다.71)
Peramivir
이 약물은 다른 약물과의 상호작용에 대한 연구는 수행되지 않았다.47) 이 약은 신장에서 일차적으로 배설되므로, 신장 기능을 감소시키거나 신장을 통해 배설되는 다른 약물과의 병용 시 주의를 기울여 사용하며, 환자의 신기능을 적절히 모니터링한다.47)
Peramivir와 비강투여 LAIV의 동시 사용은 평가되지 않았다.47) 그러나 peramivir는 oseltamivir와 마찬가지로 LAIV와 함께 투여 시 백신의 효능을 저하시킬 수 있다.47) 항바이러스 약물인 peramivir는 바이러스 복제를 억제하며, 따라서 백신의 효능 저하가 우려되므로 두 약물의 동시사용은 피해야 한다.48) 의학적으로 지시되지 않는 한 peramivir 투여 전 2주 이내 또는 투여 후 48시간 내에 LAIV 사용을 피하는 것이 권고된다.47,48)
Oseltamivir
Oseltamivir의 치료 및 예방 용법과 용량이 다르기 때문에 정확한 복약 안내가 필수적이다. 성인의 경우, 치료용으로는 총 5일 동안 75 mg을 하루에 2번씩 경구로 복용하며, 소아 및 청소년 환자는 해당 체중에 맞는 용량을 투여한다. 예방 용량은 1회 용량이 치료 용량과 동일하지만, 용법은 1일 1회 복용으로 총 투여 용량은 치료 용량의 절반이다. Oseltamivir는 식사여부와 관계없이 복용 가능하며, 12시간마다 규칙적으로 투여하는 것이 원칙이다. 만약 복용을 잊은 경우에는 기억나는 대로 즉시 복용하되, 다음 복용 시간까지 4시간 이내라면 해당 시간에 복용하고 이때 한 번에 두 배의 용량을 복용해서는 안 된다.45)
중등도 이상의 신장 장애(eGFR≤60 mL/min) 환자와 중증의 간장애(Child-Pugh score >9) 환자는 oseltamivir의 용량 조절이 필요하다. 캡슐을 삼키기 어려운 성인이나 소아 환자의 경우 캡슐을 대신하여 현탁액을 조제하여 투여할 수 있다. 현탁액 조제는 환자에게 투여하기 전에 수행되어야 하며, 이를 위해 360 mg의 oseltamivir powder를 물과 혼합하여 15 초 동안 충분히 흔들어 최종농도가 6 mg/mL가 되도록 한다. 또한, ‘잘 흔들어 주세요’ 라는 부착라벨과 함께 복약지도를 제공해야 한다. 현탁액 조제 후에는 2-8℃에서 17일간 보관하거나, 25℃ 이하에서 10일간 보관이 가능하다. 현탁용 분말의 경우 복용 순응도를 위해 사과소스 등과 섞어서 복용할 수 있다.46)
Oseltamivir와 관련된 주요 부작용 중 하나는 구역, 구토이며, 투여 후 2시간 이내에 구토가 발생할 경우 동일한 양의 반복 투여가 필요하다.46) 또한 소아, 청소년 환자에서 자살 충동이 드물게 발생하기 때문에 명확한 인과 관계는 확립되지 않았지만 주의가 필요하다. 따라서 소아, 청소년 환자에게 oseltamivir를 투여할 때는 보호자가 최소 2일 이상 잠재적인 사고를 예방하고 정신 이상 징후가 없는지 면밀히 모니터링하는 것이 좋다.63)
Peramivir
Peramivir는 oseltamivir와는 달리 인플루엔자 치료에만 사용되는 단회 정맥주사제이다.63) 성인 기준으로는 600 mg의 용량을 15분-30분 동안 1일 1회 점적정주로 투여하며, 투여 중 쇼크나 아나필락시스가 발생할 경우 즉시 투여를 중단하고 응급 처치를 시행해야 한다. Peramivir는 바이러스의 복제를 억제하는 메커니즘으로 이로 인해 비활성화된 인플루엔자 백신과의 병용은 가능하지만, 비강투여 LAIV과의 병용은 피해야 한다. 주된 부작용으로는 설사(5.8%)가 있으며, 주로 소아 및 청소년 환자에서 신경정신계 이상반응이 보고되므로 해당 이상행동 발현을 면밀히 모니터링해야 한다.48,63)
여러 연구에서 증상 완화 시간, 발열 해소 시간, 임상적 안정성(정상 체온, 심박수, 수축기 혈압) 도달 시간, 일상활동 재개 시간, 생존률, 48시간 후 바이러스 농도 변화 등에서 두 약물 그룹 간 유의한 차이가 없었다.53) 인플루엔자 바이러스 유형(A/H1N1, A/H3N2, B)에 관계없이 두 약물의 효과는 비슷한 수준이었다.51)
고위험군 환자에서도 발열 해소, 해열 시간, 생존률 면에서 peramivir와 oseltamivir 간에 유의한 차이가 없어 peramivir가 oseltamivir에 비열등했다.55) 바이러스 핵산 양성 지속기간, 임상증상 완화시간, 기침 증상 완화시간에는 두 약물군 간에 유의한 차이가 없었다.9) 3일 이내 해열률, 사망률, 입원기간, 중환자실 체류기간 등에서는 두 약물군 간 차이가 없었다.58) 하지만 일부 연구에서 발열 증상 완화시간은 peramivir군이 oseltamivir군보다 유의하게 짧았으며 24시간 후 체온 정상화율은 peramivir 그룹이 oseltamivir 그룹보다 높았다. 호흡기 증상의 경우 peramivir 300 mg 단회 투여군이 oseltamivir군 보다 증상 호전이 빨랐다.60) 인플루엔자 A, 천식, 낮은 기저 증상 등의 하위집단에서는 peramivir 300 mg이 oseltamivir보다 더 효과적이었다.48) 인플루엔자 A 바이러스 감염 시 oseltamivir군의 임상회복률이 peramivir군보다 유의하게 더 높았으며, 세균 동반감염 시에는 입원기간도 더 짧았다.62) 인플루엔자 B 바이러스 감염 시에는 두 약물군 간의 회복률과 입원기간 차이가 없었다.62)
대부분의 부작용은 경미하거나 중등도 수준이었다. 심각한 부작용 발생률에는 약물별 유의한 차이가 없었다. 가장 흔한 심각한 부작용은 QT간격 연장, 중성구 감소증, 위장관 장애(설사) 등이었다. Peramivir 그룹에서 중성구 감소 발생률은 oseltamivir 그룹과 유사했다.45) 2급 또는 3급의 중증 약물 부작용은 두 그룹 모두에서 발생하지 않았다.63) 전반적으로 두 약물 모두 안전성 측면에서 큰 문제는 없었지만, 부작용 발생 시 주의 깊게 경과 관찰이 필요하다.
Peramivir와 oseltamivir는 인플루엔자 치료 효과와 안전성 측면에서 큰 차이가 없지만 약가에서 큰 차이가 있다. 성인을 대상으로 한 인플루엔자 치료의 총 약값을 비교할 때, oseltamivir는 건강보험 급여 대상으로 약값이 10,630- 17,310원 수준이다. 그에 반해 peramivir는 비급여 의약품이므로 투여 기관에 따라 8~17만원으로 oseltamivir보다 훨씬 더 고가의 비용이 소요된다. 따라서 경제적 부담을 고려할 때는 oseltamivir를 선택하는 것이 바람직하다. 그러나 의식 저하나 합병증이 있는 중증 환자이거나 경구 투여가 어려운 환자의 경우에는 peramivir가 더 적합할 수 있다.49)
Oseltamivir과 peramivir는 인플루엔자 바이러스 감염증 치료에 널리 사용되는 NA 억제제로, 각각 5일간 경구 투여, 또는 단회 정맥내 주사제로 투여되는 약물이다. 임상연구에서는 두 약물간의 인플루엔자 치료 효과에 차이가 없다는 연구들이 다수 있으며, 일부 연구에서는 peramivir 또는 oseltamivir가 더 우월하다는 보고도 있다. 약물 이상반응의 경우 두 약물에서 위장관계 이상반응이 흔히 보고되었고, oseltamivir 투여로 인해 소아 및 청소년 환자에서 정신신경학적 사건이 보고되어 NA 억제제 사용시 소아 및 청소년 환자의 면밀한 모니터링 필요성이 대두되었지만, 두 약물간 안전성에는 큰 차이를 보이지 않았다. 다만 두 약물 간의 약가 측면에 있어서 급여인 oseltamivir보다 비급여인 peramivir가 훨씬 더 고가이다. 이러한 요소들을 종합적으로 고려하여 개별 환자에게 효과, 안전성, 편의성, 비용 등을 고려한 적절한 인플루엔자 치료제 사용과 이에 대한 복약지도가 필요해 보인다.
- 1. World Health Organization. Influenza (Seasonal). https://www.who.int/news-room/fact-sheets/detail/influenza-(seasonal). 2024.05.29.
- 2. Petrova VN, Russell CA. The evolution of seasonal influenza viruses. Nat Rev Microbiol 2018;16(1):47-60.
-

- 3. Tong S, Li Y, Rivailler P, Conrardy C, Alvarez Castillo DA, Chen L, Recuenco S, Ellison JA, Davis CT, York IA, Turmelle AS, Moran D, Rogers S, Shi M, Tao Y, Weil MR, Tang K, Rowe LA, Sammons S, Xu X, Frace M, Lindblade KA, Cox NJ, Anderson LJ, Rupprecht CE, Donis RO. A distinct lineage of influenza A virus from bats. Proc Natl Acad Sci USA 2012;109(11):4269-74.
-

- 4. Tong S, Zhu X, Li Y, Shi M, Zhang J, Bourgeois M, Yang H, Chen X, Recuenco S, Gomez J, Chen L, Johnson A, Tao Y, Dreyfus C, Yu W, McBride R, Carney PJ, Gilber AT, Chang J, Guo Z, Davis CT, Paulson JC, Stevens J, Rupprecht CE, Holmes EC, Wilson IA, Donis RO. New world bats harbor diverse influenza A viruses. PLoS Pathog 2013;9(10) :e1003657.
-

- 5. Rota PA, Wallis TR, Harmon MW, Rota JS, Kendal AP, Nerome K. Cocirculation of two distinct evolutionary lineages of influenza type B virus since 1983. Virology 1990;175(1): 59-68.
-

- 6. Eccles R. Understanding the symptoms of the common cold and influenza. Lancet Infect Dis 2005;5(11):718-25.
-

- 7. Mosnier A, Caini S, Daviaud I, Nauleau E, Bui T, Debost E, Bedouret B, Agius G, Werf S, Lina B, Cohen JM;GROG network. Clinical characteristics are similar across type A and B influenza virus infections. PLoS One 2015;10(3):e0121305.
-

- 8. Peltola V, Ziegler T, Ruuskanen O. Influenza A and B virus infections in children. Clin Infect Dis 2003;36(3):299-305.
-

- 9. Korean disease control and prevention agency. 2022-2023 Seasonal Influenza and Respiratory Virus Surveillance. 2024.1.8
-

- 10. Korean disease control and prevention agency. Pathogen and Vector Surveillance Weekly Report. 2024.3.13
-

- 11. Bischoff WE, Swett K, Leng I, Peters TR. Exposure to influenza virus aerosols during routine patient care. J Infect Dis 2013;207(7):1037-46.
-

- 12. Stockton J, Ellis JS, Saville M, Clewley JP, Zambon MC. Multiplex PCR for typing and subtyping influenza and respiratory syncytial viruses. J Clin Microbiol 1998;36(10):2990-5.
-

- 13. Lee K, Williams KV, Englund JA, Sullivan SG. The potential benefits of delaying seasonal influenza vaccine selections for the northern hemisphere: A retrospective modeling study in the United States. J Infect Dis 2023;17:541-54
-

- 14. Demicheli V, Jefferson T, Di Pietrantonj C, Al-Ansary LA, Ferroni E, Thorning S, Thomas RE. Vaccines for preventing influenza in the elderly. Cochrane Database Syst Rev 2018;2:283-89CD004876.
-

- 15. Belongia EA, Simpson MD, King JP, Sundaram ME, Kelley NS, Osterholm MT, McLean HQ. Variable influenza vaccine effectiveness by subtype: a systematic review and meta-analysis of test-negative design studies. Lancet Infect Dis 2016;16:942-51.
-

- 16. Giles ML, Krishnaswamy S, Macartney K, Cheng A. The safety of inactivated influenza vaccines in pregnancy for birth outcomes: a systematic review. Hum Vaccin Immunother 2019;15:687-99.
-

- 17. Goins WP. New age-appropriate influenza vaccines for the oldest adults. Drugs Aging 2022;10:1007-11
- 18. AstraZeneca. AstraZeneca's FluMist Quadrivalent vaccine for use by eligible individuals aged 18-49 years accepted for FDA review. 2023.03.24.
-

- 19. Caspard H, Mallory RM, Yu J, Ambrose CS. Live-attenuated influenza vaccine effectiveness in children from 2009 to 2015-2016: A systematic review and meta-analysis. Open Forum Infect Dis 2016;3:ofw111.
-

- 20. Tenforde MW, Weber ZA, Yang DH, DeSilva MB, Dascomb K, Irving SA, Naleway AL, Gaglani M, Fireman B, Lewis N, Zerbo O, Goddard K, Timbol J, Hansen JR, Grisel N, Arndorfer J, McEvoy CE, Essien IJ, Rao S, Grannis SJ, Kharbanda AB, Natarajan K, Ong TC, Embi PJ, Ball SW, Dunne MM, Kirshner L, Weigand RE, Dickerson M, Patel P, Ray C, Flannery B, Garg S, Adams K, Klien NP. Influenza vaccine effectiveness against influenza A-associated emergency department, urgent care, and hospitalization encounters among US adults, 2022-2023. J Infect Dis 2024;14:542-54
-

- 21. Li APY, Cohen CA, Leung NHL, Fang VJ, Gangappa S, Sambhara S, Levine MZ, Luliano AD, Perera RAPM, Ip DKM, Peiris JSM, Thompson MG, Cowling BJ, Valkenburg SA. Immunogenicity of standard, high-dose, MF59-adjuvanted, and recombinant-HA seasonal influenza vaccination in older adults. NPJ Vaccines 2021;6:25.
-

- 22. Van Buynder PG, Konrad S, Van Buynder JL, Brodkin E, Krajden M, Ramler G, Bigham M. The comparative effectiveness of adjuvanted and unadjuvanted trivalent inactivated influenza vaccine (TIV) in the elderly. Vaccine 2013;31:6122-8.
-

- 23. Reed SG, Orr MT, Fox CB. Key roles of adjuvants in modern vaccines. Nat Med 2013;19:1597-608.
-

- 24. son MG. Influenza Other Respir Viruses. 2021;15(1):4-13.
- 25. Health Insurance Review & Assessment Service. Notice No. 2018-259 (Notice on Reporting Discontinued Production, Import and Supply of Pharmaceuticals). 2018.11.2
- 26. Bright RA, Medina MM, Xu X, Perez-Oronoz G, Wallis TR, Davis XM, Povinelli L, Cox NJ, Klimov AI. Incidence of adamantane resistance among influenza A(H3N2) viruses isolated worldwide from 1994 to 2005. Antimicrob Agents Chemother. 2005;49(4):1421-6.
-

- 27. Ministry of food and drug safety. Drug Safety Communication Letter. 2006.1.17
- 28. son MG. Antiviral treatments. Clin Chest Med. 2017;38(1): 139-153.
-

- 29. Korea Health Industry Development Institute. Re-evaluation Report 2020 on the Safety of Oseltamivir in Children and Adolescents. 2020.9
- 30. Ministry of food and drug safety. Domestic peramivir product licensing details. https://nedrug.mfds.go.kr/pbp/CCBBB01/getItemDetailCache?cacheSeq=201004999aupdateTs2024-02-29 16:03:17.0b. 2024.05.29
- 31. Dunn CJ, Goa KL. Zanamivir: a review of its use in influenza. Drugs 1999;58(4):761-84.
-

- 32. Ministry of food and drug safety. Domestic zanamivir licensing status. https://nedrug.mfds.go.kr/pbp/CCBBB01/getItemDetailCache?cacheSeq=200008732aupdateTs2024-03-29 08:10:15.149249b. 2024.05.29
- 33. Korea pharmaceutical information center. Domestic baloxavir product licensing details. https://www.health.kr/searchDrug/result_drug.asp?drug_cd=2021022500034. 2024.05.29
- 34. kematsu H, Kawai N. Laninamivir octanoate: a new long-acting neuraminidase inhibitor for the treatment of influenza. Expert Rev Anti Infect Ther 2011;9(10):851-7.
-

- 35. Nakano T, Ishiwada N, Sumitani T, et al; Laninamivir Prophylaxis Study Group. Inhaled laninamivir octanoate as prophylaxis for influenza in children. Pediatrics 2016;138:e20160109.
-

- 36. Korean Disease control and prevention agency. KDCA operating supply management for peramiflu injection due to supply instability. https://biz.kpis.or.kr/kpis_biz/index.jsp?sso=ok. 2024.05.29
- 37. Kohno S, Yen MY, Cheong HJ, Hirotsu N, Ishida T, Kadota J, Mizuguchi M, Kida H, Shimada J. Phase III randomized, double-blind study comparing single-dose intravenous peramivir with oral oseltamivir in patients with seasonal influenza virus infection. Antimicrobial Agents and Chemotherapy, 55(11), 5267–5276.
-

- 38. Antiviral drugs for influenza for 2023-2024, The Medical Letter. https://secure.medicalletter.org/TML-article-1689a#refsa2, 2024.05.30
- 39. Korea Institute of Drug Safety & Risk Management. Guidelines for the use of influenza therapy. https://www.drugsafe.or.kr/iwt/ds/ko/bbs/EgovBbs.do?bbsId=BBSMSTR_000000000342&nttId=4630&pageIndex=1&searchCnd=0&searchWrd=인플루엔자. 2024.03.28.
- 40. Laborda P, Wang SY, Voglmeir J. Influenza neuraminidase inhibitors: synthetic approaches, derivatives and biological activity. Molecules 2016; 21(11):1513.
-

- 41. GubarevaL, Mohan T. Antivirals targeting the neuraminidase. Cold Spring Harb Perspect Med(CSH) 2022;12(1):a038455.
-

- 42. Chairat K, Tarning J, White NJ, Lindegardh N. Pharmacokinetic properties of anti-influenza neuraminidase inhibitors. The Journal of Clinical Pharmacology 2013;53(2):119-239.
-

- 43. Wester A, Shetty AK. Peramivir injection in the treatment of acute influenza: a review of the literature. Infection and Drug Resistance 2016;9:201-204.
-

- 44. Alame MM, Massaad E, Zaraket H. Peramivir: A novel intravenous neuraminidase inhibitor for treatment of acute influenza infections. Front. Microbiol 2016;7:450.
-

- 45. Ministry of Food and Drug Safety. Details of Drug ‘Tamiflu capsule 75 mg (Oseltamivir)’. https://nedrug.mfds.go.kr/pbp/CCBBB01/getItemDetailCache?cacheSeq=200008798aupdateTs2024-02-28 11:05:52.0b. 2024.03.27.
- 46. 4ational Library of Medicine. Dosage and administration ‘Oseltamivir capsule’. ps://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=82685c2f-791b-440f-a1c2-5a032da7adca. 2024.03.27.
- 47. Ministry of Food and Drug Safety. Details of Drug ‘Peramiflu Inj. 15 ml (Peramivir phosphate)’. https://nedrug.mfds.go.kr/pbp/CCBBB01/getItemDetailCache?cacheSeq=201004999aupdateTs2024-02-28 11:07:13.0b. 2024.03.27.
- 48. National Library of Medicine. Dosage and administration ‘RAPIVAB-peramivir solution’. https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=fe04f6cd-e71c-4bd4-abac-97720bba2a0d. 2024.03.27.
- 49. Korea Pharmaceutical Information Center. Search for the drug ‘Oseltamivir’. https://www.health.kr/searchDrug/result_more.asp. 2024.03.28.
- 50. DailyPharm. Green Cross is leading in influenza injection treatment… Chong Kun Dang is becoming a dark horse. https://www.dailypharm.com/Users/News/NewsView.html?ID=309336&REFERER=NP. 2024.02.29.
- 51. Kohno S, Yen MY, Cheong HJ, Hirotsu N, Ishida T, Kadota J, Mizuguchi M, Kida H, Shimada J. Phase Ⅲ randomized, double-blind study comparing single-dose intravenous peramivir with oral oseltamivir in patients with seasonal influenza virus infection. Antimicrobial Agents and Chemotherapy 2011;55(11):5267-5276.
-

- 52. Shobugwa Y, Saito R, Sato I, Kawashima T, Dapat C, Dapat IC, Kondo H, Suzuki Y, Saito K, Suzuki H. Clinical effectiveness of neuraminidase inhibitors-oseltamivir, zanamivir, laninamivir, and peramivir-for treatment of influenza A(H3N2) and A(H1N1)pdm09 infection: an observation study in the 2010-2011 influenza season in Japan. J Infect Chemotherapy 2012;18(6):858-864.
-

- 53. son MG, Hui DS, Clezy K, O’Neil BJ, Flynit A, Collis PJ, Simon TJ, Alexander WJ. A clinical trial of intravenous peramivir compared with oral oseltamivir for the treatment of seasonal influenza in hospitalized adults. Antiviral Therapy 2013;18(5):651-661.
-

- 54. Takemoto Y, Asai T, Ikezoe I, Yano T, Ichikawa M, Miyagawa S, Matsumoto J. Clinical Effects of oseltamivir, zanamivir, laninamivir and peramivir on seasonal influenza infection in outpatients in japan during the Winter of 2012-2013. Chemotherapy 2013;59(5):373-378
-

- 55. Yoshino Y, Seo K, Koga I, Kitazawa T, Ota Y. Clinical efficacy of peramivir in adult patients with seasonal influenza during the winter of 2012 in japan. The Clinical Respiratory Journal 2015;9(2):228-232.
-

- 56. Nakamura S, Miyazaki T, Izumikawa K, Kakeya H, Saisho Y, Yanagihara K, Miyazaki Y, Mukae H, Kohno S. Efficacy and safety of intravenous peramivir compared with oseltamivir in high-risk patients infected with influenza A and B viruses: a multicenter randomized controlled study. Open Forum Infectious Diseases 2017;4(3).
-

- 57. Hirotsu N, Saisho Y, Hasegawa T, Shishido T. Clinical and virologic effects of four neuraminidase inhibitors in influenza A virus-infected children (aged 4-12 years): an open-label, randomized study in japan. Expert Review of Anti-infective Therapy 2018;16(2):173-182.
-

- 58. Lee JS, Lee MS, Park YS, Lee J, Joo EJ, Eom JS. Clinical effectiveness of intravenous peramivir versus oseltamivir for the treatment of influenza in hospitalized patients. Infection and Drug Resistance 2020;13:479-1484.
-

- 59. Hsieh YH, Dugas AF, LoVecchio F, McBryde B, Ricketts EP, Saliba-Shaw K, Rothman RE. Intravenous peramivir vs oral oseltamivir in high-risk emergency department patients with influenza: Results from a pilot randomized controlled study. Influenza and Other Respiratory Viruses 2020;15(1):121-131
-

- 60. Chen HD, Wang X, Yu SL, Ding YH, Wang ML, Wang JN. Clinical effectiveness of intravenous peramivir compared with oseltamivir in patients with severe influenza A with primary viral pneumonia: a randomized controlled study. Open Forum Infectious Disease 2020;8(1).
-

- 61. Kato M, Saisho Y, Tanaka H, Bando T. Effect of peramivir on respiratory symptom improvement in patients with influenza virus infection and pre-existing chronic respiratory disease: Findings of a randomized, open-label study. Influenza and Other Respiratory Viruses 2021;15(1):132- 141.
-

- 62. Xu M, Cai T, Yue T, Zhang P, Huang J, Liu Q, Wang Y, Luo R, Li Z, Luo L, Ji C, Tan X, Zheng Y, Whitley R, Clercq ED, Yin Q, Li G. Comparative effectiveness of oseltamivir versus peramivir for hospitalized children (aged 0-5 years) with influenza infection. International Journal of Infectious Disease 2023;128:157-165.
-

- 63. Ministry of Food and Drug safety. Information booklet on appropriate use of medication for pediatric/adolescent population. https://www.mfds.go.kr/brd/m_218/view.do?seq=33514. p507-509. 2024.03.27
- 64. Ministry of Food and Drug Safety. Medication safety letter. Influenza treatment (oseltamivir phosphate) precaution for administration. 2024.03.28
- 65. Harrington R, Adimadhyam S, Lee TA, Schumock GT, Antoon JW. The relationship between oseltamivir and suicide in pediatric patients 2018;16(2):145-148
-

- 66. Hugh K, Kang M, Shin D, Hong J, Jung J. Oseltamivir and the risk of neuropsychiatric events: a national, population-based study. Clinical Infectious Diseases 2020;71(9):406–414.
-

- 67. Ministry of Food and Drug Safety. Medication safety letter. Influenza treatment (oseltamivir, zanamivir, peramivir) precaution for Administration 2024.03.28.
- 68. Gerald G. Briggs, Craig V. Towers, Alicia B. Forinash, PharmD. Briggs Drugs in Pregnancy and Lactation, 12th ed. Wolters Kluwer, 2022:978 – 979.
- 69. Ministry of Food and Drug Safety. DUR ingredient information ‘Peramivir’. 2024.03.28.
- 70. Lee SH, Kang HR, Jung JW, Kwon JW, Hong KS, Yu KS, Cho SH. Effect of oseltamivir on bleeding risk associated with warfarin therapy: a retrospective review. Clinical Drug Investigation 2012;32:131-7
-

- 71. Wagner J, Abdel-Rahman SM. Oseltamivir-warfarin interaction in hypoplastic left heart syndrome: case report and review. Pediatrics 2015;135(5):1333-6
-

 This Article
This Article
-
2024;10(2):85-97
Published on Nov 30, 2024
- Received on Oct 18, 2024
- Revised on Oct 31, 2024
- Accepted on Nov 11, 2024
 Services
Services
Shared
 Correspondence to
Correspondence to
- Yun Jeong Lee
-
College of Pharmacy, Dankook University 119, Dandae-ro, Dongnam-gu, Cheonan-si, Chungnam, 31116, Republic of Korea
Tel: +82-41-550-1445, Fax: +82-41-559-789 - E-mail: yunlee@dankook.ac.kr