 Case Report
Case Report - Impact of Long-term Proton Pump Inhibitor Therapy on Suspected Small Intestinal Bacterial Overgrowth: A Case Report with Literature Review
Eunbi Kim1, Hyunji Koo1,*
1College of Pharmacy, Kyungsung University, 309 Suyeong-ro, Nam-gu, Busan, 48434, Republic of Korea
- 장기 양성자펌프억제제 사용 후 발생한 소장세균과증식증 의심 사례: 증례보고 및 문헌고찰
김은비1, 구현지1,*
1경성대학교 약학대학
This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Background: Small intestinal bacterial overgrowth (SIBO) results from excessive or altered bacterial colonization in the small intestine and is associated with impaired gastric acidity, disrupted bile acid metabolism, and reduced intestinal motility. Proton pump inhibitors (PPIs), widely used for acid-related disorders, may increase SIBO risk by diminishing gastric acid–dependent bacterial clearance and altering gut microbial ecology. Recent reviews report a two- to threefold higher SIBO risk among long-term PPI users. Case Presentation: A 65-year-old woman with gastroesophageal reflux disease received intermittent PPI therapy from 2017 to 2025. Early short-term rabeprazole use reflected mild symptoms. From 2019, therapy escalated to esomeprazole with adjunctive agents such as chenodeoxycholic/ursodeoxycholic acid. By 2023, a prolonged 90-day course of esomeprazole coincided with bloating, diarrhea, and malabsorption, leading to initiation of rifaximin. Recurrence of symptoms in 2024–2025 required repeated rifaximin courses and introduction of tegoprazan. Discussion: The patient’s clinical progression suggests that sustained acid suppression may have contributed to shifts in microbial composition, bile acid imbalance, and impaired intestinal motility—physiologic changes known to predispose to SIBO. Repeated need for rifaximin supports ongoing gut dysbiosis and possible recurrence. Conclusion: This case underscores the importance of reassessing long-term PPI therapy, considering step-down or on-demand strategies, and evaluating SIBO or bile acid–related disorders when gastrointestinal symptoms persist despite acid suppression.
Keywords: Proton pump inhibitors, Small intestinal bacterial overgrowth, Acid suppression, Rifaximin, Bile acid metabolism
소장세균과증식증(small intestine bacterial overgrowth syndrome, SIBO)은 소장 내 세균 수가 증가하거나 세균의 종류가 비정상적으로 변화하는 것이 특징인 매우 이질적인 증후군이다. 인체에는 세균과증식을 방지하기 위하여 내인성 방어기전이 작동한다. 위산분비, 장운동, 장분비물 내 면역글로불린, 췌장 및 담즙 분비이 정균 효과 등이 포함된다. SIBO의 병인은 이런 항균 방어기전의 장애와 관련된다. 무산증, 췌장 위분비 기능저하, 면역결핍 증후군, 소장 폐쇄, 게실, 당뇨병성 자율신경병증, 전신경화증 등이 있다.1)
양성자펌프억제제(proton pump inhibitors, PPIs)는 위식도역류질환(gastroesophageal reflux disease, GERD), 소화성 궤양 질환, 산 관련 소화불량, 과다 위산 분비 질환(예: 졸링거-엘리슨 증후군)과 같은 산 관련 질환의 치료제로 선택되는 약물이다. 또한 항생제와 병용 시 Helicobacter pylori 제균 치료에도 사용된다. PPIs는 중환자실에 입원한 소화성 궤양 병력이 있는 환자에서 궤양 예방 목적으로 사용될 수 있으며, 비스테로이드성 소염진통제를 사용하는 환자에서도 적응증이 된다.2) PPIs가 널리 사용되며 관련된 안전성 문제도 제기되고 있다. 위 산도의 비타민 B12, 칼슘, 철분의 흡수 감소 및 폐렴, C. difficile, 세균성 장염, 골밀도 감소 등의 이상반응이 보고되어 있다.3)
본 증례는 위식도질환을 동반한 환자에서 반복된 PPIs 사용과 소장세균과증식증의 증상을 보이는 사례를 보고한다.
1960년생 65세 여성 환자로 ‘식도염을 동반한 위식도역류병’ 진단받고 2017년 이후 매년 간헐적으로 15일에서 30일간 PPIs를 처방 받아왔다. 2023년 PPI 사용과 함께 설사 증상으로 rifaximin을 반복 처방받아 치료받고 있다(Table 1).
|
Table 1 Prescription history of acid-suppressive therapy and concomitant medications |
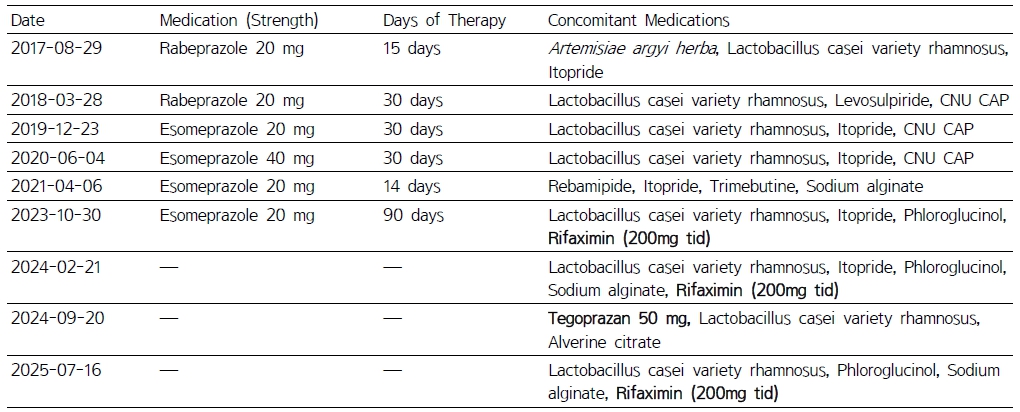
본 사례는 2017년부터 2025년까지 약 9년간의 약물 처방 이력을 통해, 초기의 단순한 기능성 소화불량 또는 경증 GERD에서 시작된 증상이 점차 만성화되고, 장기간 반복된 PPI 사용이 장내 미생물 환경 변화와 SIBO 발생에 기여했을 가능성을 보여준다. 2017-2018년에는 rabeprazole이 단기 처방되고 위장운동 촉진제와 프로바이오틱스가 병용되어 비교적 경증의 증상 관리 전략으로 해석된다. 그러나 2019-2021년에는 esomeprazole로 치료가 강화되고 rebamipide, trimebutine, sodium alginate 및 CNU CAP(chenodeoxycholic/ursodeoxycholic acid) 등이 추가되어, 지속적 또는 재발하는 상부위장관 증상이 존재했음을 시사한다. 이 시기의 장기 위산 억제는 소장 내 산도 감소를 초래하여 세균 증식 및 균총 변화라는 SIBO의 병태생리적 기반을 형성할 수 있다.1)
2023년에는 esomeprazole 90일 처방과 함께 rifaximin이 처음 사용되었고, 이는 복부팽만・설사・흡수장애 등 SIBO 의심 증상이 본격적으로 평가된 시점으로 보인다. 이후 2024-2025년에는 rifaximin의 반복 투여와 함께 P-CAB (potassium-competitive acid blocker)인 tegoprazan이 등장하여 기존 PPI에 대한 불충분 반응이나 rebound hypersecretion 가능성을 시사하며, SIBO의 재발 가능성 또한 높음을 보여준다. 장기간 acid suppression이 SIBO 위험 증가 및 담즙산 대사 이상과 연관된다는 기존 문헌과도 일치하며, 본 사례에서 반복적으로 사용된 CNU CAP 역시 담즙산 관련 기능 변화와 연결될 수 있다.1,4)
장기 PPI 사용이 장내 미생물 환경에 미치는 영향과 SIBO 발생 기전
PPI의 장기 사용이 SIBO 발생 위험을 증가시키는 병태생리적 연관성은 여러 단계의 생리학적 변화를 통해 설명될 수 있다. 첫째, PPI는 위산 분비를 강력하게 억제함으로써 위의 세균 제거(barrier) 기능을 약화시킨다. 정상적인 위산도는 외부에서 유입되거나 상부 소장에서 역류한 세균의 증식을 억제하는 핵심 방어기전이지만, 장기간의 저산증 상태에서는 이러한 방어가 무력화된다.1) 둘째, 위산 억제는 상부 소장의 pH를 상승시키며, 이는 세균의 생존과 번식을 촉진하는 환경을 조성한다. 실제로 pH 상승은 그람음성 세균 및 혐기성 세균의 성장을 용이하게 해, 소장 내 세균총의 양적・질적 변화를 일으키는 것으로 보고되어 있다.1) 셋째, 저산증은 담즙산 대사(bile acid metabolism)에도 영향을 미친다. 정상적인 소화 과정에서는 1차 담즙산이 장내 미생물에 의해 2차 담즙산으로 전환되지만,5) 위산 억제로 인한 미생물 구성 변화는 이 전환 과정을 비정상적으로 변화시키며, 이는 장내 세균총의 추가적인 교란을 야기한다. 담즙산 대사 이상은 장 점막 투과성 변화, 세균 adherence 증가, 장내 염증 반응 활성화를 유발해 SIBO의 병태생리와 밀접하게 연결된다. 또한 저산증 상태가 지속될 경우 장 운동성 저하(slow transit)가 발생할 수 있으며, 이는 소장 내 내용물 정체(stasis)를 유발하여 세균 과증식을 더욱 촉진하는 악순환을 만든다.1) 이와 같은 병태생리적 연결고리는 관찰연구 및 메타분석 결과와도 일치한다. 한 대규모 메타분석에서는 PPI 장기 투여 환자의 SIBO 발생 위험이 비사용군 대비 약 2~3배 증가하는 것으로 보고하였으며,2),6) 이는 PPI 사용이 단순한 연관성을 넘어 소장 세균 환경에 구조적 변화를 일으킬 수 있음을 시사한다. 특히 일부 연구에서는 만성 PPI 사용자에서 lactulose breath test 양성률이 유의하게 높아지고, 세균총 변화 및 세균정체 현상이 더 빈번하게 관찰되었다고 보고하고 있다.7) 이러한 근거는 본 증례에서 장기간 acid suppression therapy 이후 복부팽만·설사·흡수장애 등 SIBO 의심 증상이 발현된 흐름과도 일관성을 보인다. 따라서 본 사례의 임상 경과는 PPI 장기 사용과 SIBO 발생 사이의 기전적・역학적 연관성을 실제 임상에서 확인한 사례라는 점에서 중요한 시사점을 갖는다.
PPIs 사용의 적절성에 대한 검토
본 사례의 PPI 사용 이력을 단계별로 평가하면 다음과 같은 문제점과 적절성 여부를 확인할 수 있다. 먼저 초기인 2017–2018년에는 경증 GERD 또는 기능성 소화불량에 대해 단기간으로 PPI를 경험적으로 투여한 것으로 보인다. 이 시기의 처방은 비교적 짧은 기간에 국한되었으며, 위장운동 촉진제와 프로바이오틱스가 보조적으로 사용되었다는 점에서 당시의 임상 상황에서는 수용 가능한 범위의 단기 치료 전략으로 해석된다.4)
그러나 2019–2021년으로 접어들면서 상황이 달라진다. PPI의 반복적인 처방은 상부위장관 증상과 내시경, 24시간 pH 모니터링, H. pylori 검사 등 객관적인 재평가 과정이 명확히 이루어졌어야 한다. 이런 재평가가 이루어 지지 않았다면, PPI의 종류가 esomeprazole로 강화되고 점막보호제, 운동조절제, 담즙산 조절제(CNU CAP) 등이 추가되어 치료 강도가 높아지는 양상을 보이는 것도 위식도역류병의 치료가이드라인이 제시하는 “증상 재발 시 진단 재평가 후 장기요법 고려”라는 권고와는 일정 부분 괴리가 있는 접근일 수 있다.4)
이후 2023–2025년에 이르러 esomeprazole의 90일 이상 장기 투여가 이루어졌으며, 증상 지속과 함께 rifaximin이 반복적으로 처방되었다. 이는 단순한 GERD의 악화보다는 SIBO 가능성을 의식한 치료 전략으로 보이지만, 동시에 장기간의 강력한 산 억제 치료가 유지되고 있다는 점에서 산 억제 치료의 적정성 문제가 제기된다. 여기에 2024년 이후 P-CAB 추가된 점은, 기존 PPI에 대한 불충분 반응 또는 rebound acid hypersecretion 가능성을 추정하게 한다.8) 그러나 이 시점에서도 명확한 장기 PPI 치료의 적응증(예: 중증 미란성 식도염, Barrett 식도)이 제시되지 않았고, 환자는 지속적으로 SIBO 의심 증상으로 rifaximin을 투여받고 있다는 점에서, 임상적으로는 acid suppression 강도와 기간을 줄이거나, on-demand 또는 step-down 전략을 도입하거나, 기능성 질환・담즙산 설사・SIBO 등 GERD 이외의 원인에 대한 재평가가 반드시 고려되었어야 하는 시점이었다고 해석된다.4)
본 환자의 PPI 사용은 초기에는 비교적 적절하였으나, 중기 이후 장기간 산 억제가 지속된 점에서, SIBO 발생을 촉진할 수 있는 위험요인이 누적되었음을 시사한다.
Rifaximin 반복 처방의 해석과 chenodeoxycholic acid · ursodeoxycholic acid의 의미
Rifaximin은 SIBO의 효과적인 치료법으로 제시되고 있으나, SIBO는 항생제 치료 후 9개월내 재발률이 44%로 매우 높으며, acid suppression의 지속은 재발 위험을 더욱 증가시키는 요인으로 알려져 있다. 따라서 본 사례에서 rifaximin의 반복 처방은 일회성 감염치료라기보다, 장내 환경 장애가 지속되었음을 시사한다.1,7)
담즙산은 장내 미생물총과 상호작용하여 항균・항염 작용을 수행하나, SIBO 상황에서는 탈결합된 담즙산 증가로 인해 지방 흡수 장애 및 설사가 악화된다. 본 환자에서 chenodeoxycholic/ursodeoxycholic acid가 반복 처방된 점은 SIBO와 연관된 담즙산 대사 이상이 동반되었을 가능성을 강화한다.1)
본 사례는 PPI 반복 처방 후 SIBO 의심 증상이 발현된 임상 경과를 통해, 장기적인 위산 억제가 소장 미생물 환경의 변화를 촉진하고 SIBO 발생 위험을 증가시킬 수 있음을 보여준다. 장기간의 PPI 강화요법이 명확한 적응증 재평가 없이 지속되면서 저산증・담즙산 대사 변화・장운동 저하 등 SIBO를 유발할 수 있는 병태생리적 요인이 누적되었다.
따라서 본 사례는 GERD 환자에서 PPI 장기 요법의 적정성 검토, 필요 시 on-demand 또는 step-down 전략 도입, 그리고 SIBO 및 담즙산 관련 질환에 대한 주기적 재평가의 중요성을 강조한다. 장기간의 acid suppression therapy는 반드시 근거 기반 적응증에서 사용되어야 하며, 증상 악화 시 PPI 증량보다 먼저 타 질환 감별과 장내 미생물환경 변화에 대한 평가가 필요하다.
- 1. Bures J, Cyrany J, Kohoutova D, et al. Small intestinal bacterial overgrowth syndrome. World journal of gastroenterology: WJG 2010; 16(24): 2978.
-

- 2. Lo WK, Chan WW. Proton pump inhibitor use and the risk of small intestinal bacterial overgrowth: a meta-analysis. Clinical Gastroenterology and Hepatology 2013; 11(5): 483-90.
-

- 3. Yang YX, Metz DC. Safety of proton pump inhibitor exposure. Gastroenterology 2010; 139(4): 1115-27.
-

- 4. Katz PO, Dunbar KB, Schnoll-Sussman FH, et al. ACG clinical guideline for the diagnosis and management of gastroesophageal reflux disease. Official journal of the American College of Gastroenterology| ACG 2022; 117(1): 27-56.
-

- 5. Ramírez-Pérez O, Cruz-Ramón V, Chinchilla-López P, et al. The role of the gut microbiota in bile acid metabolism. Annals of hepatology 2018; 16(1): 21-6.
-

- 6. Su T, Lai S, Lee A, et al. Meta-analysis: proton pump inhibitors moderately increase the risk of small intestinal bacterial overgrowth. Journal of gastroenterology 2018; 53(1): 27-36.
-

- 7. Quigley EM, Murray JA, Pimentel M. AGA clinical practice update on small intestinal bacterial overgrowth: expert review. Gastroenterology 2020; 159(4): 1526-32.
-

- 8. Waldum HL, Qvigstad G, Fossmark R, et al. Rebound acid hypersecretion from a physiological, pathophysiological and clinical viewpoint. Scandinavian journal of gastroenterology 2010; 45(4): 389-94.
-

 This Article
This Article
-
2025;11(2):61-64
Published on Nov 30, 2025
- Received on Nov 15, 2025
- Revised on Nov 20, 2025
- Accepted on Nov 27, 2025
 Services
Services
Shared
 Correspondence to
Correspondence to
- Hyunji Koo
-
College of Pharmacy, Kyungsung University, 309 Suyeong-ro, Nam-gu, Busan, 48434, Republic of Korea
Tel: +82-51-663-4894 - E-mail: happygooz@ks.ac.kr







